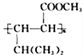题目内容
【题目】A、B、C、D为中学常见的混合物分离或提纯的基本装置,请回答:

(1)分离植物油和水,选择装置______(填序号),主要使用仪器名称__________;
(2)分离乙二醇和丙三醇的混合溶液,选择装置______(填序号)。
物质 | 熔点 (摄氏度) | 沸点(摄氏度) | 密度(g/cm-3) | 溶解性 |
乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比例互溶 |
【答案】B 分液漏斗 A
【解析】
(1)植物油和水互不相溶,则分离植物油和水应选择分液操作,选择装置B,主要使用仪器名称为分液漏斗;
(2)乙二醇和丙三醇相互混溶,且存在沸点差异,则分离乙二醇和丙三醇的混合溶液,选择蒸馏操作,选择装置A。

【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
实验编号 | 0.01molL﹣1 酸性KMnO4溶液 | 0.1molL﹣1 H2C2O4溶液 | 水 | 某种物质 | 反应温度/℃ | 反应时间(min) |
Ⅰ | 2ml | 2ml | 0 | 0 | 20 | 2.1 |
Ⅱ | V1ml | 2ml | 1ml | 0 | 20 | 5.5 |
Ⅲ | V2 ml | 2ml | 0 | 0 | 50 | 0.5 |
Ⅳ | 2ml | 2ml | 0 | 少量 | 20 | 0.2 |
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学程式表示该实验的实验原理:__________________________________________________________________。
(2)实验计时方法是从溶液混合开始记时,至_________________时记时结束。
(3)V1=_____,V2=_____;设计实验Ⅰ、Ⅲ的目的是______________________________。
(4)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=________。
(5)有同学在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定过程中溶液不同时间的温度,结果温度没有明显变化。由此你得出的结论是:
①________不是反应速率突然加快的原因;
②可能是反应产物有催化作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________。