题目内容
【题目】以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下所示。
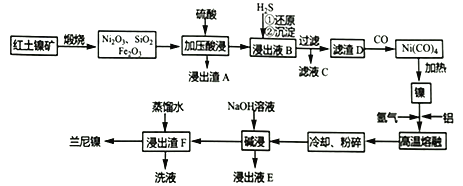
(1)形成Ni(CO)4时碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________。
(2)Ni2O3有强氧化性,加压酸浸时有气体产生且镍被还原为Ni2+,则产生的气体为______(填化学式)。
(3)滤渣D为单质镍、硫的混合物,请写出向浸出液B中通入H2S气体时所有反应的离子方程式:__________________________,_________________________。
(4)已知:3Fe2++2[Fe(CN)6]3-==Fe3[Fe(CN)6]2↓(蓝色沉淀);4Fe3++3[Fe(CN)6]4-==Fe4[Fe(CN)6]3↓(蓝色沉淀)。下列可以用于检验滤液C中金属阳离子的试剂有____________(填标号)
a.KSCN溶液 b.K3[Fe(CN)6] c.K4[Fe(CN)6] d.苯酚
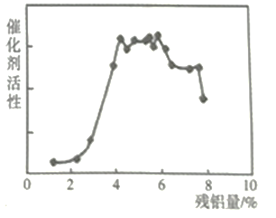
(5)兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金。碱浸镍铝合金后,残铝量对兰尼镍的催化活性有重大影响,根据下图分析,残铝量在_____范围内催化活性最高,属于优质产品。
(6)仿照下面示例,设计从浸出液E回收氧化铝的流程:浸出液E_________________。
(示例:![]() )
)
【答案】 0 O2 H2S+2Fe3+==2Fe2++2H++S↓ H2S+Ni2+==Ni↓+2H++S↓ b 4%~6% ![]()
【解析】(1)Ni(CO)4中碳为+2价、氧-2价,故Ni的化合价为0;(2)Ni2O3有强氧化性,加压酸浸时有气体产生且镍被还原为Ni2+,Ni的化合价降低,则氧元素的化合价应升高,则产生的气体为O2;(3)滤渣D为单质镍、硫的混合物,浸出液B含有Fe3+、Ni2+,向其中通入H2S气体时Fe3+被还原为Fe2+,同时生成硫单质,且Ni2+被还原为单质,反应的离子方程式:H2S+2Fe3+==2Fe2++2H++S↓、H2S+Ni2+==Ni↓+2H++S↓;(4)根据上述分析,过滤后得到滤液C含有Fe2+,检验滤液C中金属阳离子的试剂可选择.K3[Fe(CN)6],答案选b;(5)根据下图分析,残铝量在4%~6%范围内催化活性最高,属于优质产品;(6)从浸出液E回收氧化铝的流程可表示为:浸出液E![]() 。
。

 阅读快车系列答案
阅读快车系列答案