题目内容
【题目】酸雨形成的原理之一可表示如下:
含硫燃料![]() A
A![]() B
B![]() 硫酸
硫酸
请回答下列问题。
(1)A的化学式为__________,B的化学式为__________________________________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)雨水的pH小于5.6时,就判定为酸雨。已知pH=-lgc(H+),经测定某次雨水所含酸性物质只有硫酸,且其浓度为5×10-5mol·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、CO2等。为了除去有害的SO2气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生可采取的措施是__________(填字母)。
A.少用煤作燃料 B.把工厂的烟囱建高
C.燃料脱硫 D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________(填“可取”或“不可取”),理由是__________________________________________________。
【答案】SO2 SO3 ③ 还原剂 是 ACE 不可取 未减少二氧化硫的总排放量
【解析】
(1)含硫燃料在氧气中燃烧往往生成SO2,SO2经催化氧化生成SO3,SO3与水反应生成硫酸。
(2)从价态是否变化的角度分析判断。
(3)二氧化硫中硫的价态降低,需要加还原剂提供电子;
(4)先算H+浓度,再算pH,然后与5.6比较。
(5)建立“地球村”的理念,设法从根本上解决污染问题。
(1)含硫燃料燃烧往往生成SO2,二氧化硫在催化剂、加热条件与氧气反应生成SO3,所以A和B的化学式分别为SO2、SO3;
(2)所给的三个反应,前2个反应明显是氧化还原反应,第3个反应中元素的价态没有发生变化,属于非氧化还原反应;
(3) 此方案的目标是将二氧化硫中+4价的硫降为0价,所以需要外加还原剂来实现;
(4)硫酸的浓度为5×10-5mol·L-1,所以H+的浓度为10-4mol·L-1,该溶液的pH=-lgc(H+)=4,pH明显小于5.6,所以这次降雨属于酸雨;
(5)①燃煤中往往含有硫元素,少用煤作燃料或将燃煤进行脱硫处理,都可以较好地降低二氧化硫的排放量,从而减少硫酸型酸雨的产生。开发新能源可以更有效地减少酸雨的产生,答案选ACE;
②从全球环境保护的角度来看,建设烟囱的方法不可取。因为这种做法,实质上并未减少二氧化硫的总排放量,只是导致当地的二氧化硫的含量偏低,大量的二氧化硫随空气流动扩散到了别处。

 小学课时特训系列答案
小学课时特训系列答案【题目】下列各组物质,不能按如图(“→”表示反应一步完成)关系转化的是

选 项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
【题目】(10分)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如下图所示,
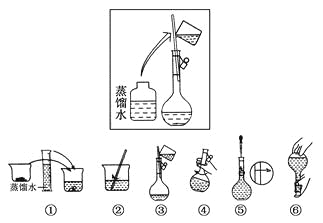
则如图操作应在下图中的________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
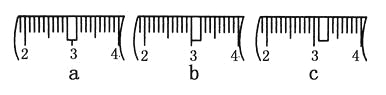
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会________。