题目内容
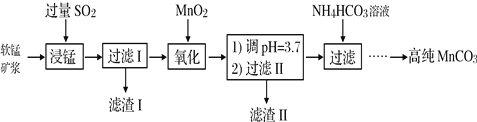
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
【答案】向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞处是否漏水 液体分上下两层,下层呈紫红色 AB 5NaI+NaIO3+3H2SO4===3Na2SO4+3I2↓+3H2O 过滤 碘易升华,会导致碘的损失
【解析】
(1)分液漏斗的检漏方法是:向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞处是否漏水。
(2)碘水中加入CCl4萃取的现象是:液体分上下两层,下层呈紫红色。
(3)步骤Y是用NaOH溶液反萃取,为了将CCl4中溶解的I2全部转化成易溶于水的离子,要使用稍过量的NaOH溶液,故“应控制NaOH溶液的浓度和体积”,选项A、B正确。
(4)“上层”溶液中的溶质是NaI和NaIO3,加入H2SO4溶液后发生归中反应生成固体碘: 5NaI+NaIO3+3H2SO4===3Na2SO4+3I2↓+3H2O;过滤分离出粗碘。
(5)碘易升华,会导致碘的损失。

【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液由______;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_______;
(3)该小组在步骤①中的错误是______,由此造成的测定结果________(填“偏高”或“偏低”或“无影响”);
(4)步骤②缺少的操作是_____;
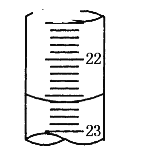
(5)如上图是某次滴定时的滴定管中的液面,其读数为___mL;
(6)根据下列数据:
测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
滴定前读数/mL | 滴定后读数/mL | ||
第一次 | 25.00 | 0.40 | 20.38 |
第二次 | 25.00 | 4.00 | 24.02 |
请计算待测烧碱溶液的物质的量浓度。(请写出解答过程)_______________