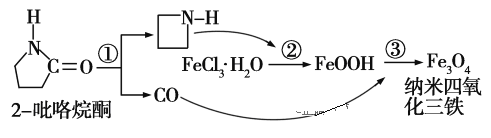
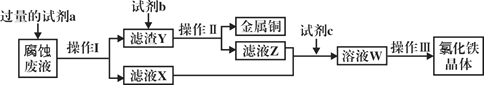
��Ŀ����
����Ŀ�����ʵ����ͺ���Ԫ�صĻ��ϼ����о��������ʵ�������Ҫά�ȡ���ͼΪ���䲿�ֻ�������������άͼ���� ����ͼʾ�ش��������⣺
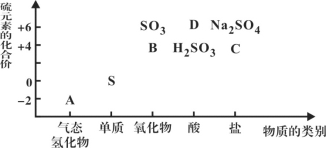
(1)ͼ��A��B��C��D���������У����ڷǵ���ʵ���__________(�û�ѧʽ��ʾ)��
(2)����Bͨ����ɫʯ����Һ��������______________________________________��
FeCl3��Һ(����)��ͨ��B�����ӷ���ʽΪ___________________________��
(3)C�ڷ�Ӧ�мȿ������������ֿ�����ԭ����������������ʱ����������ɱ���ԭΪ____(����)��
A��Na2S B��S C��H2SO3 D��Na2SO4 E��H2SO4
(4)����Ԫ�ػ��ϼ۷��������ʾ��������Ժͻ�ԭ�ԡ����һ��˵�������������(�û�ѧ����ʽ��ʾ)_______________________________��
(5)��A��SO2��ϣ������ɵ���ɫ���塣�÷�Ӧ�����������뻹ԭ���������֮��Ϊ__________________________��
���𰸡�SO2 ʯ����Һ��ɺ�ɫ 2Fe3++SO2+2H2O=2Fe2++SO42��+4H+ AB Fe+S![]() FeS��H2+S
FeS��H2+S![]() H2S 2��1
H2S 2��1
��������
����ͼ���ļ�̬�����ʵĶ�Ӧ��ϵ������ȷ������A��B��C��D�������ʷֱ�ΪH2S��SO2��Na2SO3��H2SO4��
��1��ͼ��A��B��C��D���������У����ڷǵ���ʵ���SO2�����ڵ���ʵ���H2S��Na2SO3��H2SO4��ͨ���ǽ������������ڷǵ���ʣ��ᡢ������ڵ���ʣ�
��2��SO2ͨ����ɫʯ����Һ�����Ƿ�Ӧ����H2SO3��SO2+H2O![]() H2SO3������������H+ʹʯ���Ժ�ɫ��FeCl3������Һ��ͨ��SO2ʱ������Ӧ�����ӷ���ʽ��2Fe3++SO2+2H2O=2Fe2++SO42-+4H+��
H2SO3������������H+ʹʯ���Ժ�ɫ��FeCl3������Һ��ͨ��SO2ʱ������Ӧ�����ӷ���ʽ��2Fe3++SO2+2H2O=2Fe2++SO42-+4H+��
��3��CΪNa2SO3������SΪ+4�ۣ�����������������ԭʱ����Ļ��ϼ۽����ͣ���������ֻ��Na2S��S�е���Ԫ�ػ��ϼ۵���+4�ۣ���ѡA���B�
��4����Ԫ�ػ��ϼ۷�������������Ϊ0�ۣ������м��̬���Ⱦ��������Ժͻ�ԭ�ԡ���������������ʱ��ͨ�����ϼ۽�Ϊ-2�ۣ����統�������������Ϊ������Ӧʱ��Fe+S![]() FeS����������Ӧʱ��H2+S
FeS����������Ӧʱ��H2+S![]() H2S��
H2S��
��5��H2S��SO2�������巢����Ӧ��2H2S+SO2=3S+2H2O������������ͻ�ԭ�����ΪS�����л�ԭ����ÿ����1mol��������������2mol���������������뻹ԭ��������ʵ���֮��Ϊ2��1����������Ҳ��2��1��