题目内容
【题目】在澄清透明的强酸性溶液中能大量共存的离子组是( )
A. NH4+、Mg2+、SO42、Cl- B. Ba2+、K+、OH-、NO3-
C. Al3+、Cu2+、SO42-、Cl- D. Na+、Ca2+、Cl-、HCO3-
【答案】A
【解析】A、四种离子在溶液中均是无色的,且在酸性溶液中不反应,可以大量共存,A正确;B、在酸性溶液中氢氧根离子不能大量共存,B错误;C、铜离子在溶液中显蓝色,不是无色的,不能大量共存,C错误;D、在酸性溶液中碳酸氢根离子与氢离子反应生成CO2和水,不能大量共存,D错误,答案选A。

练习册系列答案
相关题目
【题目】利用酸性含锰废水(主要含Mn2+、Cl﹣、H+、Fe2+、Cu2+)可制备高性能磁性材料(MnCO3)及纯净的氯化铜晶体(CuCl22H2O).工业流程如图: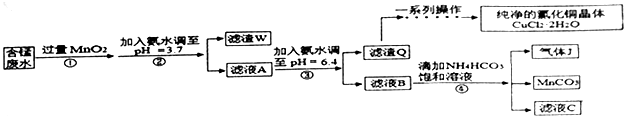
已知:几种金属离子沉淀的pH如表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列问题:
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+ , 反应的离子方程式为
(2)过程②中,所得滤渣W的成分是 .
(3)过程③中,调pH=6.4目的是 .
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是 .
(5)将滤渣Q溶解在过量的盐酸中,经过 , 过滤、洗涤、低温烘
(6)过程④中,298K、c(Mn2+)为1.05mol/L时,实验测得MnCO3的产率与溶液pH、反应时间关系如图据图中信息,你选择的最佳pH是;理由是 . 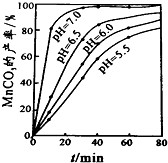
(7)从滤液C可得到的副产品是(填化学式).