题目内容
【题目】利用酸性含锰废水(主要含Mn2+、Cl﹣、H+、Fe2+、Cu2+)可制备高性能磁性材料(MnCO3)及纯净的氯化铜晶体(CuCl22H2O).工业流程如图:
已知:几种金属离子沉淀的pH如表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列问题:
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+ , 反应的离子方程式为
(2)过程②中,所得滤渣W的成分是 .
(3)过程③中,调pH=6.4目的是 .
(4)过程④中,若生成的气体J可使澄清的石灰水变浑浊,则生成MnCO3反应的离子方程式是 .
(5)将滤渣Q溶解在过量的盐酸中,经过 , 过滤、洗涤、低温烘
(6)过程④中,298K、c(Mn2+)为1.05mol/L时,实验测得MnCO3的产率与溶液pH、反应时间关系如图据图中信息,你选择的最佳pH是;理由是 . 
(7)从滤液C可得到的副产品是(填化学式).
【答案】
(1)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(2)Fe(OH)3和过量的MnO2
(3)使Cu2+ 完全沉淀为Cu(OH)2
(4)Mn2++2HCO3﹣=MnCO3↓+CO2↑+H2O
(5)加热浓缩,降温结晶
(6)7.0,pH等于7.0时反应速率最快,且MnCO3产率最高
(7)NH4Cl
【解析】解:(1)MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
所以答案是:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(2)根据流程分析可知,所得滤渣W的成分是Fe(OH)3和过量的MnO2;
所以答案是:Fe(OH)3和过量的MnO2;
(3)调pH=6.4,除去溶液中的铜离子,使Cu2+ 完全沉淀为Cu(OH)2;
所以答案是:使Cu2+ 完全沉淀为Cu(OH)2;
(4)滤液B含有Mn2+、Cl﹣,加碳酸氢铵反应生成二氧化碳气体、碳酸锰、氯化铵、水,其反应的离子方程式为:Mn2++2HCO3﹣=MnCO3↓+CO2↑+H2O;
所以答案是:Mn2++2HCO3﹣=MnCO3↓+CO2↑+H2O;
(5)从溶液中提取溶质,要经过加热浓缩,降温结晶,过滤、洗涤、低温烘干;
所以答案是:加热浓缩,降温结晶;
(6)从沉锰的图象可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高,
所以答案是:7.0;pH等于7.0时反应速率最快,且MnCO3的产率最高;
(7)得到的滤液中还有大量的铵根离子和氯离子没有反应,因此可以制的副产品为:NH4Cl,
所以答案是:NH4Cl.

 53天天练系列答案
53天天练系列答案【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
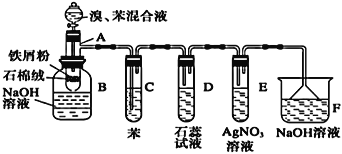
(A为具有支管的试管,在其下端开了一个小孔。塞好石棉绒。再加入少量铁屑粉)
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水溶性 | 微溶 | 微溶 | 微溶 |
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中有机物发生的反应方程式(有机物写结构简式):______________________,反应类型为______________。
(2)反应开始后,可观察到D中溶液变红,E中出现__________________,试管C中苯的作用是__________。用相关化学用语解释D中溶液变红的原因________________。
(3)反应2~3min后,在B中可观察到在溶液中出现红色絮状沉淀、底部有油状液体。生成红色絮状沉淀的离子方程式为_______________________________。
(4)向B中分离出的油状液体加入少量无水氯化钙,静置、过滤。加入氯化钙的目的是________________。
(5)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必需的是______(填入正确选项前的字母)。
A.蒸发 B.过滤 C.蒸馏 D.萃取
(6)在A~F中,具有防倒吸作用的有_________(填字母)。
