题目内容
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法. 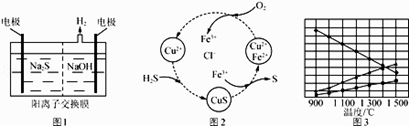
(1)将烧碱吸收H2S后的溶液加入到如图1所示的电解池的阳极区进行电解.电解过程中阳极区发生如下反应:S2-﹣2e﹣═S (n﹣1)S+S2﹣═Sn2﹣①写出电解时阴极的电极反应式: .
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示. ①在图示的转化中,化合价不变的元素是 .
②反应中当有1mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为 .
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有 .
(3)H2S在高温下分解生成硫蒸气和H2 . 若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图3所示,H2S在高温下分解反应的化学方程式为 .
【答案】
(1)2H++2e﹣=H2↑;Sn2﹣+2H+=(n﹣1)S↓+H2S↑
(2)Cu、H、Cl;0.5mol;增大混合气体中空气的比例
(3)2H2S ![]() 2H2+S2
2H2+S2
【解析】解:(1)①阳极上硫离子放电,电极反应式为S2﹣﹣2e﹣═S,阴极上氢离子放电生成氢气,电极反应式为2H++2e﹣=H2↑, 所以答案是:2H++2e﹣=H2↑;②电解后阳极区离子为Sn2﹣ , 酸性条件下,Sn2﹣和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2﹣+2H+=(n﹣1)S↓+H2S↑,
所以答案是:Sn2﹣+2H+=(n﹣1)S↓+H2S↑;(2)①根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是﹣1价,所以化合价不变的是Cu、H、Cl元素,
所以答案是:Cu、H、Cl;②H2S不稳定,易被氧气氧化生成S单质,反应方程式为2H2S+O2=2S+2H2O,该反应中S元素化合价由﹣2价变为0价、O元素化合价由0价变为﹣2价,根据氧化还原反应中得失电子相等得,反应中当有1mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,消耗O2的物质的量= ![]() =0.5mol,
=0.5mol,
所以答案是:0.5mol;③使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质,所以氧气必须过量,采取的措施是:增大混合气体中空气的比例;
所以答案是:增大混合气体中空气的比例;(3)根据题意知,该反应是可逆反应,反应物是硫化氢,根据图像知,生成物中含有S元素的物质是氢气的一半,则生成物是S2和H2 , 所以该反应方程式为2H2S ![]() 2H2+S2 ,
2H2+S2 ,
所以答案是:2H2S ![]() 2H2+S2 .
2H2+S2 .