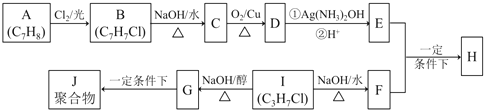
题目内容
【题目】与下列反应对应的离子方程式书写正确的是
A. 铁跟稀硫酸反应 2Fe+6H+=2Fe3++3H2↑
B. 碳酸钙溶于醋酸 CaCO3+2H+=Ca2++H2O+CO2↑
C. Na2CO3溶液的水解 CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. 碳酸镁跟硫酸反应 MgCO3+2H+=Mg2++H2O+CO2↑
【答案】D
【解析】
A.铁跟稀硫酸反应生成硫酸亚铁和氢气,离子方程式是Fe+2H+=Fe2++H2↑,故A错误;
B. 碳酸钙溶于醋酸生成醋酸钙、水、二氧化碳,离子方程式是CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C. Na2CO3溶液的水解分步进行,离子方程式是CO32-+H2O![]() HCO3-+OH-,故C错误;
HCO3-+OH-,故C错误;
D. 碳酸镁跟硫酸反应生成硫酸镁、水、二氧化碳,离子方程式是MgCO3+2H+=Mg2++H2O+CO2↑,故D正确。

 阅读快车系列答案
阅读快车系列答案【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以硫酸渣制备铁红(Fe2O3),过程如下:
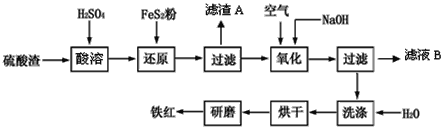
(1)酸溶过程中Fe2O3与稀硫酸反应的离子方程式是____。
(2)还原过程中加入FeS2是将溶液中的Fe3+ 还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:_____。
(3)生产过程中,为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是__。
(部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(二)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
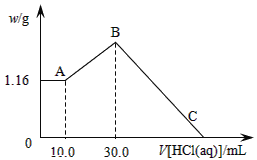
(1)原混合物中NaOH的质量是____g。
(2)C点(此时沉淀恰好完全溶解)HCl溶液的体积为___mL。
(三)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。回答下列问题:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过如图1过程制备ClO2:
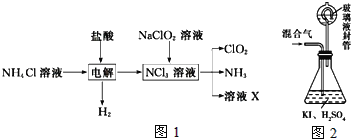
用如图2装置可以测定混合气中ClO2的含量:
Ⅰ、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ、将一定量的混合气体通入锥形瓶中吸收;
Ⅳ、将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ、用0.1000molL1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-═2I+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①测得混合气中ClO2的质量为___g。
②用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___(填标号).
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
【题目】用分液漏斗向锥形瓶中滴加液体至过量,下列对锥形瓶中现象的预测符合实际情况的是
选项 | 锥形瓶 | 分液漏斗 | 预测现象 |
A | 酸性KMnO4溶液 | H2O2溶液 | 溶液紫红色逐渐褪去且产生大量气泡 |
B | Na2S溶液 | 久置氯水 | 生成淡黄色沉淀 |
C | Fe(OH)3胶体 | 盐酸 | 产生红褐色沉淀 |
D | Na2CO3溶液 | H2BO3溶液 | 产生大量气泡 |
A. AB. BC. CD. D