题目内容
【题目】欲配制0.2mol/L 的NaOH溶液980mL,有以下仪器:
①烧杯②漏斗③托盘天平(带砝码)④玻璃棒⑤胶头滴管
(1)配制时,必须使用的仪器有____________(填代号),还缺少的玻璃仪器是____________________。该实验中两次用到玻璃棒,其作用分别是____________________,____________________。
(2)使用容量瓶前必须进行的一步操作是_____________________。
(3)根据计算应用托盘天平称量NaOH_______g。
(4)请你分析下列哪些操作会引起所配浓度偏大________(填写字母)。
A.将NaOH放在滤纸上称量
B.称取NaOH的砝码已生锈
C.容量瓶未干燥即用来配制溶液
D.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容;
E.往容量瓶转移时,有少量液体溅出
F.在容量瓶中定容时视线如图所示
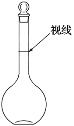
G.烧杯未进行洗涤
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
(5)若定容时不小心使液面超过了刻度线,应采取的措施是_____________
【答案】①③④⑤ 1000 mL容量瓶 搅拌加速溶解 引流 检漏 8.0 g B D F 重新配制
【解析】
(1)根据配制一定物质的量浓度的溶液的步骤是:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀可知需要的仪器有:托盘天平、药匙、烧杯、玻璃棒、1000mL容量瓶和胶头滴管,因此答案选①③④⑤,还缺少的玻璃仪器是1000 mL容量瓶。该实验中两次用到玻璃棒,其中溶解时玻璃棒搅拌加速溶解,转移时起引流作用;
(2)容量瓶含有塞子,因此使用容量瓶前必须进行的一步操作是检漏;
(3)由于没有980mL容量瓶,需要使用1000mL容量瓶,所以应用托盘天平称量NaOH固体的质量是0.2mol/L×1L×40g/mol=8.0g;
(4)A.由于氢氧化钠易吸水,将NaOH放在滤纸上称量,溶质的质量减少,浓度偏低;
B.称取NaOH的砝码已生锈,溶质的质量增加,浓度偏高;
C.容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响;
D.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容,恢复到室温后溶液体积减少,浓度偏高;
E.往容量瓶转移时,有少量液体溅出,溶质的质量减少,浓度偏低;
F.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
G.烧杯未进行洗涤,溶质的质量减少,浓度偏低;
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,溶液体积增加,浓度偏低。
答案选BDF;
(5)若定容时不小心使液面超过了刻度线,实验失败,所以应采取的措施是重新配制。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D