题目内容
12.下列各组离子在一定条件下能够大量共存的是( )| A. | 无色溶液:Cu2+、K+、MnO4-、SO42- | |
| B. | 能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 常温下c(OH-)=1×10-13mol•L-1的溶液:NH4+、Al3+、SO42-、Cl- | |
| D. | 含1.2 mol•L-1 NO3-的溶液:H+、Fe2+、Mg2+、Br- |
分析 A.铜离子、高锰酸根离子为有色离子;
B.能溶解Al2O3的溶液为酸性或强碱性溶液,碳酸氢根离子能够与酸和碱溶液反应;
C.常温下c(OH-)=1×10-13mol•L-1的溶液为酸性溶液,溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
D.硝酸根离子在酸性条件下能够氧化亚铁离子、溴离子.
解答 解:A.Cu2+、MnO4-为有色离子,不满足溶液无色的条件,故A错误;
B.能溶解Al2O3的溶液中存在大量氢离子或氢氧根离子,HCO3-既能够与氢离子反应,也能够与氢氧根离子反应,在溶液中一定不能大量共存,故B错误;
C.常温下c(OH-)=1×10-13mol•L-1的溶液中存在大量氢离子,NH4+、Al3+、SO42-、Cl-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.NO3-H+能够氧化Fe2+、Br-,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
相关题目
2.关于各组溶液中微粒浓度的关系正确的是( )
| A. | 将一定量氨气通入0.1 mol/L NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 等物质的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c( HCO3-)+c( H2CO3)+c(CO32-) | |
| C. | 向CH3COONa溶液中滴加稀盐酸至溶液呈中性时有:c(Cl-)>c( Na+)>c( CH3COOH) | |
| D. | 等浓度等体积的CH3COOH溶液和CH3COONa溶液混合均匀后:c(CH3COO-)+c(CH3COOH)=c(Na+) |
3.下列叙述正确的是( )
| A. | 铅蓄电池放电过程中,正极质量增加,负极质量减小 | |
| B. | 将0.1 mol•L-1的NH3•H2O溶液加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值减小 | |
| C. | NaHCO3溶于水,溶液中存在电离平衡 | |
| D. | CaCO3(s)═CaO(s)+CO2(g),△H>0,该反应在任意温度下都能自发进行 |
20.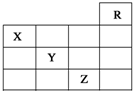 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
①X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐
②同浓度的Y、Z的气态氢化物的水溶液的酸性Y<Z
③Z的单质常温下是深红棕色液体,具有氧化性
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )①X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐
②同浓度的Y、Z的气态氢化物的水溶液的酸性Y<Z
③Z的单质常温下是深红棕色液体,具有氧化性
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
| A. | 只有③ | B. | 只有①④ | C. | 只有①②③④ | D. | ①②③④⑤ |
1.结晶牛胰岛素是中国科学家于1965年在世界上第一个人工合成的,其具有生物活性,那么结晶牛胰岛素本质上是什么( )
| A. | 糖类 | B. | 脂肪 | C. | 维生素 | D. | 蛋白质 |
2.某种烃与H2 1:1加成后的产物是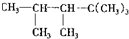 则该烃的结构式可能有则该烯烃的结构( )
则该烃的结构式可能有则该烯烃的结构( )
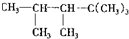 则该烃的结构式可能有则该烯烃的结构( )
则该烃的结构式可能有则该烯烃的结构( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
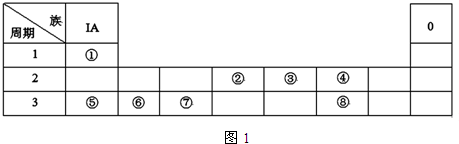
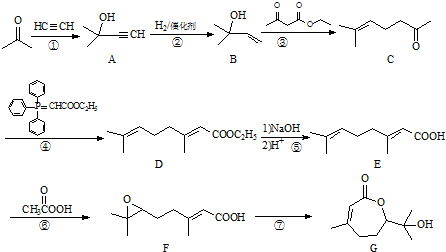
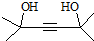 .
.
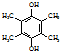
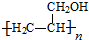 ,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.