题目内容
10.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:A.在250mL的容量瓶中定容配成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是C→A→B→D→E (均用字母填写).
(2)滴定管的读数应注意滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,读数精确到0.01mL.
(3)E中在锥形瓶下垫一张白纸的作用是便于准确判断终点时颜色的变化情况.
(4)D步骤中液面应调节到调节到零刻度或零稍下的某一刻度,尖嘴部分应充满溶液,无气泡.
(5)滴定终点时锥形瓶内溶液的pH约为4.4,终点时颜色变化是溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色.
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?偏高(填“偏高”“偏低”或“不变”).
(7)该烧碱样品纯度的计算式为$\frac{80c({V}_{2}-{V}_{1})}{W}$%.
分析 (1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定;
(2)滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,注意滴定管的精确值;
(3)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨;
(4)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡;
(5)指示剂为甲基橙,变色范围为3.1-4.4;
(6)因标准液浓度变小,用量变大;
(7)根据反应消耗的硫酸,求出氢氧化钠,进一步求出样品的纯度.
解答 解:(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,具体步骤为:C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解、A.在250mL容量瓶中定容成250mL烧碱溶液、B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂、D.将物质的量浓度为M mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL、E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL,
故答案为:C;A;B;E;
(2)滴定管读数时需要注意之处为:滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,滴定管读数准确到0.01mL,
故答案为:滴定管垂直,液面不再变化时才可读数,视线与溶液凹液面最低点相平,读数精确到0.01mL;
(3)在锥形瓶下垫一张白纸,可使滴定终点颜色变化更明显,便于分辨,降低滴定误差,
故答案为:便于准确判断终点时颜色的变化情况;
(4)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡,
故答案为:调节到零刻度或零稍下的某一刻度;充满溶液,无气泡;
(5)指示剂为甲基橙,变色范围为3.1-4.4,终点时pH约为4.4;液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
故答案为:4.4;溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
(6)若酸式滴定管不用标准硫酸润洗,导致标准液被稀释,则滴定过程中消耗的标准液体积增大,则测定结果偏高,
故答案为:偏高;
(7)滴到消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×cmol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2c(V2-V1)×10-3mol,
所以原来样品中氢氧化钠的物质的量为:2c(V2-V1)×10-3mol×$\frac{250mL}{25mL}$=2c(V2-V1)×10-2mol,
则样品中氢氧化钠的质量为m(NaOH)=nM=80c(V2-V1)×10-2g,
则该烧碱样品的纯度为:$\frac{40g/mol×2c({V}_{2}-{V}_{1})×1{0}^{-2}mol}{Wg}$×100%=$\frac{80c({V}_{2}-{V}_{1})}{W}$%,
故答案为:$\frac{80c({V}_{2}-{V}_{1})}{W}$%.
点评 本题考查探究物质组成、测量物质含量的方法,题目难度中等,侧重于化学实验基本操作以及物质的含量的测定等问题,建议在学习中把握相关基本实验方法,明确中和滴定操作方法为解答关键,试题培养了学生的分析能力及化学实验、化学计算能力.

| A. | 将纯水加热至较高温度,水的离子积变大,pH减小,呈酸性 | |
| B. | 碱性氢氧燃料电池工作时,OH-向正极迁移 | |
| C. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H>0 | |
| D. | 用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 淀粉,油脂和蛋白质都是高分子化合物 | |
| C. | 乙醇、乙酸均能与Na反应放出H2,但二者分子中官能团不同 | |
| D. | 甲烷和Cl2的反应与乙烯和Br2的反应不属于同一类型的反应 |
| A. | Fe2+、Ca2+、NO3-、H+ | B. | Fe2+、H+、CO32-、Cl- | ||
| C. | Fe3+、OH-、SO42-、Cl- | D. | Fe3+、NH4+、Cl-、H+ |


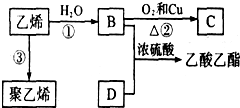 已知乙烯能发生如图转化:
已知乙烯能发生如图转化: ;反应类型:加聚反应.
;反应类型:加聚反应.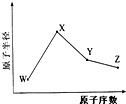 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.