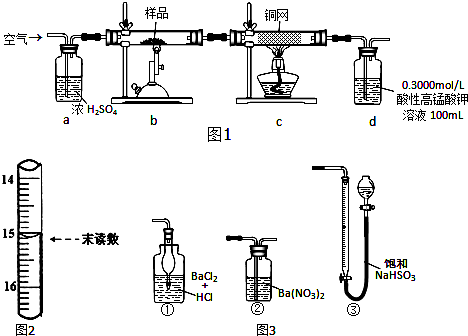
��Ŀ����
12��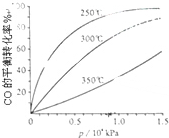 �о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ��Ӧ����ʽΪ3NO2+H2O�T2HNO3+NO�����÷�Ӧ
6NO2+8NH3$?_{����}^{����}$7N5+12H2OҲ�ɴ���NO2����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������6.72L��
��2��NH4HCO3�dz��õĵ��ʣ�����NH4+�ķ�����ȡ�����μӹ���ŨNaOH��Һ����ȣ���������������ʹʪ��ĺ�ɫʯ����ֽ������˵����NH4+��
��3����֪��2SO2��g��+O2��g��?2SO3��g����H=-196.6kJ•mol-1
2NO��g��+O2��g��?2NO2��g����H=-113.0kJ•mol-1
��ӦNO2��g��+SO2��g��?SO3��g��+NO��g���ġ�H=-41.8kJ•mol-1��
��4��һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����b��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ��� d��ÿ����1mol SO3��ͬʱ����1molNO2
��5��CO�����ںϳɼ״�����Ӧ����ʽΪ��CO��g��+2H2��g��?CH3OH��g����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H��0���������������ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ����������1.3��104kPa�£�CO��ת�����ѽϸߣ�������ѹǿCO��ת������߲��������ɱ����ӵò���ʧ����
���� ��1������������ˮ�ķ�Ӧ��������������д��ѧ��Ӧ����ʽ��������������ԭ��Ӧ�е���ת�Ƽ��㣬Ȼ������״��������������
��2��������ʹʪ��ĺ�ɫʯ����ֽ����ɫ��
��3�������Ȼ�ѧ����ʽ��˹���������㷴Ӧ�ȣ�
��4��ƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ɴ�������һЩ������Ҳ���䣻
��5�����û�ѧƽ���Ӱ�����غ�ҵ�����Ĺ�ϵ��������
��� �⣺��1��NO2��H2O��Ӧ�ķ���ʽΪ��3NO2+H2O�T2HNO3+NO��6NO2+8NH3�T7N2+12H2O������Ӧ����1 mol NO2�μӷ�Ӧʱ����ת����4 mol���ӣ���ת��1.2mol����ʱ�����ĵ�NO2Ϊ$\frac{1.2}{4}$��22.4L=6.72L��
�ʴ�Ϊ��3NO2+H2O�T2HNO3+NO��6.72L
��2����κ�ǿ���ڼ������������ɰ������������ڼ������壬��ʹʪ��ĺ�ɫʯ����ֽ����ɫ������鷽���ǣ�ȡ�����μӹ���ŨNaOH��Һ����ȣ���������������ʹʪ��ĺ�ɫʯ����ֽ������˵����NH4+��
�ʴ�Ϊ��ȡ�����μӹ���ŨNaOH��Һ����ȣ���������������ʹʪ��ĺ�ɫʯ����ֽ������˵����NH4+��
��3����2SO2��g��+O2��g��?2SO3��g����H=-196.6kJ•mol-1
��2NO��g��+O2��g��?2NO2��g����H=-113.0kJ•mol-1
���ݸ�˹���ɼ��㣨��-�ڣ���$\frac{1}{2}$�õ���ӦNO2��g��+SO2��g��?SO3��g��+NO��g������H=-41.8 kJ•mol-1��
�ʴ�Ϊ��-41.8 kJ•mol-1��
��4��a�������Ƿ�ﵽƽ�⣬��ϵѹǿ�����ֲ��䣬���������ж��Ƿ�ﵽƽ��״̬����a����
b�����������ɫ���ֲ��䣬˵��Ũ�Ȳ��䣬�ﵽƽ��״̬����b��ȷ��
c��SO3��NO�ļ�����֮��Ϊ1��1�������Ƿ�ﵽƽ�⣬���ߵ�����ȱ��ֲ��䣬�����ж��Ƿ�ﵽƽ��״̬����c����
d�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���ÿ����1mol SO3��ͬʱ����1molNO2�������ж��Ƿ�ﵽƽ��״̬����d����
�ʴ�Ϊ��b��
��5����ͼ��֪���¶����ߣ�CO��ת���ʽ��ͣ�ƽ�����淴Ӧ�����ƶ������淴Ӧ�����ȷ�Ӧ������Ӧ�Ƿ��ȷ�Ӧ����H��0��ѹǿ�������ڼӿ췴Ӧ���ʣ�������ʹƽ�������ƶ�����ѹǿ������Ҫ�Ķ������豸��Ҫ��Ҳ�ߣ���ѡ��250�桢1.3��104kPa���ҵ���������Ϊ��250�桢ѹǿΪ1.3��104 kPaʱ��CO��ת�����ѽϴ�������ѹǿ��CO��ת���ʱ仯����û�б�Ҫ������ѹǿ��
�ʴ�Ϊ��������1.3��104kPa�£�CO��ת�����ѽϸߣ�������ѹǿCO��ת������߲��������ɱ����ӵò���ʧ��
���� ���⽫Ԫ�ػ������������仯����ѧƽ���֪ʶ�����һ����п��죬��������˸߿����ۺ��ԣ��ڣ�3�����׳��������������ͼ��ע��ͼ��ı仯���Ƽ��ݺ�����ĺ��壬�Ӷ��ó���ȷ���ۣ�

 53������ϵ�д�
53������ϵ�д�| A�� | pH=1����Һ�У�NO3-��Na+��I-��Fe2+ | |
| B�� | pH=13����Һ�У�Cl-��Mg2+��CH3COO-��K+ | |
| C�� | ˮ�������c��H+��=1��10-12mol•L-1��Һ�У�HCO3-��SO42-��Na+��NH4+ | |
| D�� | pH=14����ɫ����Һ�У�K+��Na+��NO3-��CO32- |
| A�� | ����ˮ�������ϸ��¶ȣ�ˮ�����ӻ����pH��С�������� | |
| B�� | ��������ȼ�ϵ�ع���ʱ��OH-������Ǩ�� | |
| C�� | ��Ӧ2A��g��+B��g���T3C��s��+D��g����һ�����������Է����У�˵���÷�Ӧ�ġ�H��0 | |
| D�� | �ñ���Na2CO3��Һ����BaSO4�������ɽ�BaSO4ת��ΪBaCO3 |

 ��
��