题目内容
【题目】实验室可用如下方法制取Cl2,根据相关信息,回答下列问题:
(1)用双线桥法表示电子转移方向和数目_____:①MnO2 +4HCl(浓)=== Cl2↑+ MnCl2+ 2H2O
(2)若反应中有0.1mol的氧化剂被还原,则被氧化的物质为__(填化学式),被氧化的物质的量为 _____,同时转移电子数为_____。
(3)将(2)生成的氯气与 0.2mol H2 完全反应,生成的气体在标准状况下所占体积为_____L,将此产物溶于水配成100mL溶液,此溶液的物质的量浓度为_______。(已知:H2+Cl2![]() 2HCl)
2HCl)
(4)②KClO3+6HCl(浓)===3Cl2↑+KCl+3H2O③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为____。
(5)已知反应4HCl(g)+O2 ![]() 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由弱到强的顺序为_______。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由弱到强的顺序为_______。
(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到_____g固体。
【答案】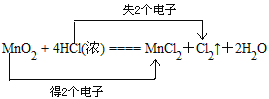
HCl 0.2mol 1.204×1023 4.48 2mol/L 6∶5∶6 O2﹤MnO2﹤KMnO4 5.85
【解析】
(1)利用化合价升降法判断氧化剂、还原剂、氧化产物及还原产物和转移电子数目;
(2)反应中二氧化锰作氧化剂,化合价降低,被还原,HCl为还原剂,被氧化,生成氯气;
(3)根据反应H2+ Cl2=2HCl,利用较少的物质完全反应进行计算;
(4)利用化合价升降法计算转移电子数目;
(5)氧化还原反应中氧化剂的氧化性越强,反应的条件越简单;
(6)根据元素守恒,反应的最终产物为NaCl进行计算。
(1)反应中Mn的化合价由+4价变为+2价,得电子,Cl的化合价由-1价变为0价,失电子,则最小公倍数为2,双线桥法为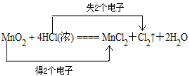 ;
;
(2)反应中二氧化锰作氧化剂,化合价降低,被还原,HCl为还原剂,被氧化,生成氯气;0.1mol MnO2反应,转移0.2mol电子,生成0.1mol氯气,则被氧化的HCl为0.2mol;
(3)n(H2):n(Cl2)=2:1,则氯气少量,为0.1mol,根据反应H2+ Cl2=2HCl,生成0.2molHCl,其标况下的体积为4.48L;c(HCl)=n/V=0.2mol/0.1L=2mol/L;
(4)若制取1mol氯气时,①转移2mol电子;②KClO3中Cl的化合价由+5变为0价,转移5个电子,生成3个氯气,则生成1mol氯气时,转移5/3mol电子;③KMnO4中Mn的化合价由+7变为+2价,转移10个电子,生成5个氯气,则生成1mol氯气时,转移2mol电子,制得相同质量的氯气,电子转移的数目之比为2:![]() :2=6:5:6;
:2=6:5:6;
(5)氧化还原反应中氧化剂的氧化性越强,反应的条件越简单,则氧化性由弱到强的顺序为O2﹤MnO2﹤KMnO4;
(6)加入的n(Cl-)=0.05mL× 2.00mol/L=0.1mol,反应的最终产物为NaCl,根据元素守恒,则n(NaCl)=0.1mol,其质量为5.85g。

 阅读快车系列答案
阅读快车系列答案










