题目内容
【题目】一定条件下,lmolCH3OH与一定量O2发生反应时,生成CO、CO2或HCHO的能量变化如下图所示[反应物O2(g)和生成物H2O(g)已略去]。

回答下列问题:
(1)在有催化剂作用下,CH3 OH与O2反应主要生成 ___(填“CO2、CO或HCHO”);计算:2HCHO(g)+O2(g)=2CO(g)+2H2O(g)![]() =_____________
=_____________
(2)已知:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]()
①经测定不同温度下该反应的平衡常数如下:

该反应为 ___(填“放热”或“吸热”)反应;250℃时,某时刻测得该反应的反应物与生成物浓度为c(CO) =0.4mol/L、c(H2) =0. 4mol/L、c(CH3 OH) =0. 8mol/L,则此时υ(正)____υ(逆)(填“>”、“=”或“<”)。
②某温度下,在体积固定的2L密闭容器中将1molCO和2molH2混合,使反应得到平衡,实验测得平衡时与起始时的气体压强比值为0 .7,则该反应的平衡常数为____(保留l位小数)。
(3)利用钠碱循环法可除去SO2。常温下,若吸收液吸收一定量SO2后的溶液中,n(SO32-):n(HSO3-) =3:2,则此时溶液呈____(填“酸性”、“中性”或“碱性”)。(已知:H2SO3的电离常数为:Kal=l. 54×10-2、Ka2=l. 02×l0-7)
(4)利用电化学法处理工业尾气SO2的装置如图所示,写出Pt(2)电极反应式:______;当电路中转移0. 02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加___ mol离子。

【答案】HCHO -470kJ·mol-1 放热 < 2.7 碱性 2HSO3-+2e-+2H+=S2O42-+2H2O 0.03
【解析】
(1)反应速率与活化能的关系,根据图像求反应热;
(2)通过平衡常数的变化判断反应的热效应,通过浓度商判断反应进行的方向;利用压强和三段式计算平衡常数;
(3)利用电离平衡常数求解c(H+);
(4)根据反应类型判断阴、阳极并书写电极反应式,根据电极反应式进行计算。
(1)从图像中可知加入催化剂生成甲醛的反应活化能小,化学反应速率快,所以主要产物为HCHO。根据图像, 1molHCHO转化为1molCO放出的能量为(676-283-158) kJ·mol-1=235 kJ·mol-1,方程式为2molHCHO,则△H需要乘以2,△H=-235×2kJ·mol-1=-470 kJ·mol-1;
(2) ①根据图中数据可知,随着温度的升高,平衡常数降低,平衡逆向移动,逆反应为吸热反应,则正反应为放热反应,该反应为放热反应;对于某时刻,浓度商![]() ,大于250℃的平衡常数2.041,反应逆向进行,正反应速率小于逆反应速率;
,大于250℃的平衡常数2.041,反应逆向进行,正反应速率小于逆反应速率;
②同温同体积的情况下,压强之比等于物质的量之比。平衡时与起始时的气体压强比值为0 .7,开始的物质的量为1mol+2mol=3mol,则平衡时的物质的量为3mol×0.7=2.1mol。
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始的物质的量 1 2 0
转化的物质的量 x 2x x
平衡的物质的量 1-x 2-2x x
1-x+2-2x+x=2.1,得x=0.45mol;体积为2L,则有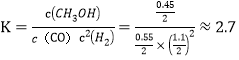 ;
;
(3) n(SO32-):n(HSO3-) =3:2,在同一溶液中,则浓度之比等于物质的量之比,亚硫酸的Ka2=![]() ,得c(H+)=6.8×10-8<10-7,溶液呈碱性;
,得c(H+)=6.8×10-8<10-7,溶液呈碱性;
(4)根据示意图,Pt(2)电极上HSO3-→S2O42-,S的化合价从+4降低到+3,电解质溶液为酸性,则电极方程式为2HSO3-+2e-+2H+=S2O42-+2H2O;Pt(2)为阴极,Pt(1)为阳极,阳极的电极反应式为SO2-2e-+2H2O=SO42-+4H+,电路中通过0. 02 mol e-时,左侧生成0.01molSO42-和0.04molH+,为平衡电荷,有0.02mol的H+经阳离子交换膜转移到右侧,则左侧的离子增加了0.03mol。

 名校课堂系列答案
名校课堂系列答案