题目内容
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-)∶c(CO32-)=2∶1,溶液pH=___。
(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=___。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___(填“A”或“B”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是___。
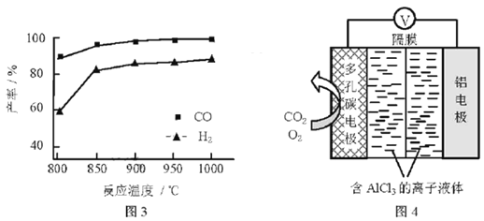
(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的正极反应式:6O2+6e=6O2 6CO2+6O2=3C2O42+6O2
反应过程中O2的作用是___。该电池的总反应式:___。
【答案】10 +120kJ·mol-1 B 900℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低 催化剂 2Al+6CO2=Al2(C2O4)3
【解析】
(1) K2=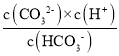 =5×10-11,且所得溶液c(HCO3-):c(CO32-)=2:1,据此计算溶液pH;
=5×10-11,且所得溶液c(HCO3-):c(CO32-)=2:1,据此计算溶液pH;
(2)①该反应的△H=反应物总键能-生成物总键能;该反应的正反应是气体物质的量增大的反应,增大压强平衡逆向移动,A在反应过程中压强在不断增大、B在反应过程中压强不变;
②900℃时合成气产率已经较高,再升高温度产率增幅不大,且升高温度耗能较大;
(3)该原电池中Al作负极,失电子生成铝离子;在正极的反应式中,在第一个反应中作反应物、在第二个反应中作生成物;在得失电子相同条件下,正负极电极反应式相加即得电池反应式。
(1) K2=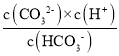 =5×10-11,且所得溶液c(HCO3-):c(CO32-)=2:1,c(H+)=
=5×10-11,且所得溶液c(HCO3-):c(CO32-)=2:1,c(H+)=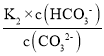 =5×1011×2=1×1010,则pH=10;
=5×1011×2=1×1010,则pH=10;
(2)①该反应的△H=反应物总键能生成物总键能=[4×413+2×7452×10752×436]kJ/mol=+120kJ/mol;该反应的正反应是气体物质的量增大的反应,增大压强平衡逆向移动,A在反应过程中压强在不断增大、B在反应过程中压强不变,所以A相当于B来说是增大压强,平衡逆向移动,所以A中反应物转化率小于B,则两容器中反应达平衡后吸收的热量较多的是B;
②根据图知,900℃时合成气产率已经较高,再升高温度产率增幅不大,且升高温度耗能较大,经济效益降低,温度低时合成气产率降低且反应速率降低;
(3)该原电池中Al作负极,失电子生成铝离子,电极反应式为Al3e=Al3+;在正极的反应式中,在第一个反应中作反应物、在第二个反应中作生成物,所以氧气在反应中作催化剂;在得失电子相同条件下,正负极电极反应式相加即得电池反应式,电池反应式为2Al+6CO2=Al2(C2O4)3。