题目内容
【题目】(1)25℃时,0.1mol/L HCl溶液中由水电离出的H+的浓度为_______;
(2)若向氨水中加入少量硫酸铵固体,此时溶液中![]() 将_______;(填“增大”、“减小”或“不变”)
将_______;(填“增大”、“减小”或“不变”)
(3)25℃时,向AgNO3溶液中加入BaCl2溶液和KBr溶液,当两种沉淀共存时,![]() =____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
=____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
(4)用离子方程式表示NH4F不能用玻璃试剂瓶装的原因________;
(5)25℃时,有下列四种溶液:A. 0.1mol/L CH3COONH4溶液 B. 0.1mol/L CH3COOH溶液 C.0.1mol/L CH3COONa溶液 D.等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液(混合液呈酸性)
① 已知A溶液呈中性,试推断(NH4)2CO3溶液呈______性(填“酸”或“碱”或“中”);
② D溶液中除H2O外所有分子、离子浓度由大到小的顺序为________;
③ 上述四种溶液中水的电离程度由小到大的顺序为________。
【答案】10-13 mol/L 减小 2.7×10-3 F-+H2O![]() HF+OH- 或NH4++F-+H2O
HF+OH- 或NH4++F-+H2O![]() HF+NH3·H2O 碱 c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) B<D<C<A
HF+NH3·H2O 碱 c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) B<D<C<A
【解析】
(1)氯化氢为强电解质,氢离子浓度等于氯化氢的物质的量浓度,根据水的离子积计算出该溶液中水电离的氢氧根离子浓度,水电离的氢离子浓度等于氢氧根离子浓度;
(2)向氨水中加入少量硫酸铵固体,铵根离子浓度增大,抑制氨水的电离,溶液中氢氧根离子浓度减小,一水合氨分子浓度增大;
(3)当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中![]() =
=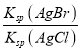 ,依此计算;
,依此计算;
(4)NH4F在溶液中水解生成HF,二氧化硅能溶于HF;
(5)①0.1mol/L CH3COONH4溶液呈中性,说明铵根离子的水解程度与醋酸根离子的水解程度相同,即氨水和CH3COOH的电离程度相同,因为醋酸的酸性比碳酸的强,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,据此判断;②等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液中含有等浓度的醋酸钠和醋酸,因为溶液显酸性,说明醋酸的电离程度大于醋酸根的水解程度,据此分析排序;③ 根据酸和碱抑制水的电离,能够水解的盐促进水的电离,结合离子间的相互影响分析判断。
(1)在25℃时,在0.1mol/L HCl溶液中,c(H+)=c(HCl)=0.1mol/L,氯化氢溶液中的氢氧根离子是水电离的,则由水电离出的c(H+)水=c(OH-)=![]() mol/L=1×10-13 mol/L,故答案为:1×10-13 ;
mol/L=1×10-13 mol/L,故答案为:1×10-13 ;
(2)由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,抑制氨水电离,导致溶液中氢氧根离子浓度减小,一水合氨分子浓度增大,所以此时溶液中![]() 减小,故答案为:减小;
减小,故答案为:减小;
(3)当两种沉淀共存时,溶液中Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=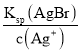 ,c(Cl-)=
,c(Cl-)=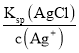 ,则
,则![]() =
=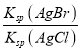 =
=![]() =2.7×10-3,故答案为:2.7×10-3;
=2.7×10-3,故答案为:2.7×10-3;
(4)NH4F在溶液中水解生成HF,其水解方程式为:F-+H2O![]() HF+OH-或NH4++F-+H2O
HF+OH-或NH4++F-+H2O![]() HF+NH3·H2O,玻璃中的二氧化硅能溶于HF,其反应为:4HF+SiO2═SiF4↑+2H2O,故答案为:F-+H2O
HF+NH3·H2O,玻璃中的二氧化硅能溶于HF,其反应为:4HF+SiO2═SiF4↑+2H2O,故答案为:F-+H2O![]() HF+OH-或NH4++F-+H2O
HF+OH-或NH4++F-+H2O![]() HF+NH3·H2O;
HF+NH3·H2O;
(5)①0.1mol/L CH3COONH4溶液呈中性,说明铵根离子的水解程度与醋酸根离子的水解程度相同,即氨水和CH3COOH的电离程度相同,因为醋酸的酸性比碳酸的强,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,溶液显碱性,故答案为:碱;
②等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液中含有等浓度的醋酸钠和醋酸,因为溶液显酸性,说明醋酸的电离程度大于醋酸根的水解程度,因此除H2O外所有分子、离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-);
③ A. 0.1mol/L CH3COONH4溶液显中性,但铵根离子和醋酸根离子均水解促进水的电离;B. 0.1mol/L CH3COOH溶液,为酸,抑制水的电离;C.0.1mol/L CH3COONa溶液水解显碱性,促进水的电离,但促进程度比A小;D.等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液含有浓度均为0.1mol/L的醋酸钠和醋酸,因为溶液显酸性,说明醋酸的电离程度大于醋酸根的水解程度,抑制水的电离,但抑制程度比B小,上述四种溶液中水的电离程度由小到大的顺序为B<D<C<A,故答案为:B<D<C<A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
i. SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2=SO![]() +4H++2I-
+4H++2I-
序号 | ① | ② | ③ | ④ |
试剂 组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验 现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较①快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较①快 |
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中),下列说法不正确的是
A. 水溶液中SO2歧化反应方程式为:3SO2+2H2O =S↓+2H2SO4
B. ②是①的对比实验,则a=0.4
C. 比较①、②、③,可得出结论:I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可加快歧化反应速率
D. 实验表明,SO2的歧化反应速率④>①,原因是反应i比ii快,反应ii中产生的H+是反应i加快