题目内容
【题目】利用生物质产品A和E为原料合成高分子和I的路线如下:
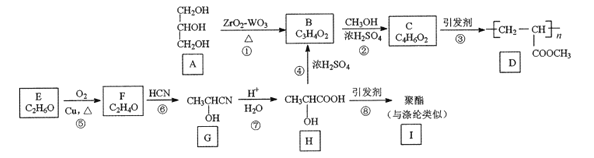
回答下列问题:
(1)A的化学名称是___________。
(2)③、⑧的反应类型依次是_______________、____________。
(3)B、I的结构简式依次是_____________、______________。
(4)反应②和⑤的化学方程式分别是_____________、_________。
(5)X与C互为同分异构体,X中含有羧基和碳碳双键,写出所有符合题意的X的结构简式:________(不考虑立体异构)。
【答案】丙三醇(甘油) 加聚反应 缩聚反应 CH2=CHCOOH  2CH3CH2OH+O2
2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O CH2=CH--COOH + CH3OH
2CH3CHO+2H2O CH2=CH--COOH + CH3OH![]() CH2=CH-COOCH3 + H2O CH2=CHCH2COOH 、CH3CH=CHCOOH 、 CH2=C(CH3)COOH
CH2=CH-COOCH3 + H2O CH2=CHCH2COOH 、CH3CH=CHCOOH 、 CH2=C(CH3)COOH
【解析】
流程本题主要采用逆推方式推测。C发生加聚反应生成D,根据D(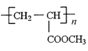 ),确定C为
),确定C为![]() ;B与甲醇发生酯化反应生成C,则B为CH2=CHCOOH;H(
;B与甲醇发生酯化反应生成C,则B为CH2=CHCOOH;H(![]() )在浓硫酸作用下,发生消去反应生成B;H发生缩聚反应生成聚酯I,则I为
)在浓硫酸作用下,发生消去反应生成B;H发生缩聚反应生成聚酯I,则I为  ;根据G可知,E为CH3CH2OH,E发生催化氧化反应生成F(CH3CHO),F与HCN发生加成反应生成G,据此分析。
;根据G可知,E为CH3CH2OH,E发生催化氧化反应生成F(CH3CHO),F与HCN发生加成反应生成G,据此分析。
(1)由已知可知A为![]() ,A的化学名称是丙三醇;
,A的化学名称是丙三醇;
答案:丙三醇
(2)根据上面分析可知,第③步反应为C发生加聚反应生成D、第⑧步的反应为H发生缩聚反应生成聚酯I;
答案:加聚反应 缩聚反应
(3)根据D(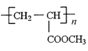 ),确定C为
),确定C为![]() ;B与甲醇发生酯化反应生成C,则B为CH2=CHCOOH;H发生缩聚反应生成聚酯I,则I为
;B与甲醇发生酯化反应生成C,则B为CH2=CHCOOH;H发生缩聚反应生成聚酯I,则I为 ;
;
答案:CH2=CHCOOH 
(4)反应②为CH3CH2OH发生催化氧化反应生成CH3CHO和水,方程式为2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;反应⑤丙烯酸和甲醇发生酯化反应生成丙烯酸甲酯和水,方程式为CH2=CH-COOH + CH3OH
2CH3CHO+2H2O;反应⑤丙烯酸和甲醇发生酯化反应生成丙烯酸甲酯和水,方程式为CH2=CH-COOH + CH3OH![]() CH2=CH-COOCH3 + H2O;
CH2=CH-COOCH3 + H2O;
答案:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O CH2=CH-COOH + CH3OH
2CH3CHO+2H2O CH2=CH-COOH + CH3OH![]() CH2=CH-COOCH3 + H2O
CH2=CH-COOCH3 + H2O
(5)C为![]() ,X与C互为同分异构体,X中含有羧基和碳碳双键,先写出碳链,在确定碳碳双键,则X可能为 CH2=CHCH2COOH 、CH3CH=CHCOOH 、 CH2=C(CH3)COOH;
,X与C互为同分异构体,X中含有羧基和碳碳双键,先写出碳链,在确定碳碳双键,则X可能为 CH2=CHCH2COOH 、CH3CH=CHCOOH 、 CH2=C(CH3)COOH;
答案:CH2=CHCH2COOH 、CH3CH=CHCOOH 、 CH2=C(CH3)COOH

 习题精选系列答案
习题精选系列答案【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-)∶c(CO32-)=2∶1,溶液pH=___。
(室温下,H2CO3的K1=4×107;K2=5×1011)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=___。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___(填“A”或“B”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是___。
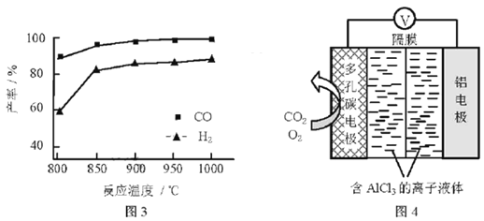
(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的正极反应式:6O2+6e=6O2 6CO2+6O2=3C2O42+6O2
反应过程中O2的作用是___。该电池的总反应式:___。
【题目】雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO![]() 2CO2(g)+N2(g)△H<0
2CO2(g)+N2(g)△H<0
①反应的速率-时间图像如图甲所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图乙所示。以下说法正确的是___________(填对应字母)。
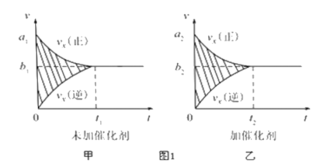
A. a1>a2 B.b1<b2 C.t1>t2 D.图乙中阴影部分面积更大E.图甲中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填代号)

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ/mol
2NO2(g)![]() N2O4(g)△H=﹣56.9kJ/mol
N2O4(g)△H=﹣56.9kJ/mol
H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:______________。
(3)CH4和H2O(g)在催化剂表面发生反应CH4+H2OCO+3H2,该反应在不同温度下的化学平衡常数如表:
温度/℃ | 800 | 1000 | 1200 | 1400 |
平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
①该反应是_________反应(填“吸热”或“放热”)。
②T℃时,向1L密闭容器中投入lmolCH4和lmolH2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O![]() CO+3H2的平衡常数K=______________。
CO+3H2的平衡常数K=______________。
【题目】乙醇是重要的化工原料,也是清洁的能源。
Ⅰ、工业上,在一定条件下用乙烯水化法制备乙醇。已知热化学方程式如下:
①CH2=CH2(g)+H2O(g)CH3CH2OH(g) ΔH1
②2CH2=CH2(g)+H2O(g)CH3CH2OCH2CH3(g) ΔH2
③2CH3CH2OH(g)CH3CH2OCH2CH3(g)+H2O(g) ΔH3
(1)几种化学键的键能如下:
化学键 | H-C | C=C | H-O | C-O | C-C |
键能kJ·mol-1 | 413 | 615 | 463 | 351 | 348 |
根据键能计算ΔH1=________________kJ·mol-1。
(2)在恒容密闭容器中发生反应②,下列能说明该反应达到平衡的是_________。
a、容器中总压强保持不变
b、H2O(g)的消耗速率与CH3CH2OCH2CH3(g)生成速率相等
c、气体平均摩尔质量保持不变
d、容器中气体密度保持不变
(3)在密闭容器中投入CH2=CH2(g)、H2O(g)和催化剂发生反应①,乙烯的平衡转化率与温度、压强的关系如图所示。

①x代表________________。(选填“温度”或“压强”)
②L1和L2哪个大?并请说出理由:_____________________________________________________。
Ⅱ、如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和lmolHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:

(4)达到平衡时,隔板K最终停留在0刻度左侧某一处,记为a处,则a的取值范围是__________。
(5)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,则该反应化学平衡常数为_______________。
(6)若一开始就将K、F如上图固定,其他条件均不变,则达到平衡时:测得甲中A的转化率为b,则乙中C的转化率为____________。