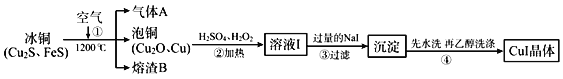
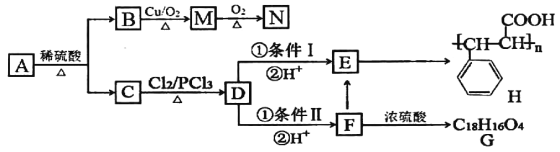
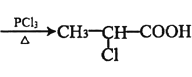题目内容
【题目】25° C时,0.100 mol· L-1盐酸滴定25. 00 mL0. 1000 mol . L-1'氨水的滴定曲线如图所示。下列说法正确的是

A.滴定时,可迄用甲基橙或酚酞为指示剂
B.a、b两点水电离出的OH-浓度之比为10-4. 12
C.c点溶液中离子浓度大小顺序为c(Cl-) >c(NH4+)>c(H+ ) >c(OH-)
D.中和等体积等pH的氨水和NaOH溶液时消耗相同浓度盐酸的体积相等
【答案】B
【解析】
A.甲基橙变色范围为3.1~4.4,酚酞变色范围为8~10,盐酸滴定氨水恰好完全反应时溶液显酸性,应选甲基橙作指示剂,故A错误;
B.a溶液呈碱性,则主要是NH3·H2O的电离抑制水解,pH=9.24,则溶液中c水(H+)=10-9.24mol/L,则水电离出的c水(OH-)=10-9.24mol/L;b点溶液呈酸性,主要是NH4+的水解促进水的电离,pH=5.12,则溶液中c水(H+)=10-5.12mol/L,则水电离出的c水(OH-)=10-5.12mol/L,所以a、b两点水电离出的OH-浓度之比为![]() =10-4.12,故B正确;
=10-4.12,故B正确;
C.c点滴加了50mL盐酸,则溶液中的溶质为NH4Cl和HCl,且物质的量浓度相同,所以溶液中离子浓度大小顺序为:c(Cl-) > c(H+ )> c(NH4+)>c(OH-),故C错误;
D.等pH的氨水和NaOH溶液,氨水的浓度要远大于氢氧化钠溶液的浓度,所以中和等体积等pH的氨水和NaOH溶液时,氨水消耗相同浓度盐酸的体积更多,故D错误;
故答案为B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min | 2 | 4 | 7 | 9 |
n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前4min的平均反应速率υ(Z)=0.0125molL-1min-1
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C. 其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大
D. 该温度下此反应的平衡常数K=1.44