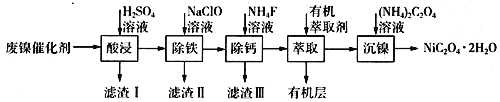
题目内容
【题目】一定量铜与100mLcmol/L的稀硝酸反应,产生1.12LNO(标准状况),反应结束后,向反应后的溶液中滴加1.0mol/L的NaOH溶液,滴加过程中,产生沉淀的质量与加入NaOH 溶液的体积关系如下图所示。
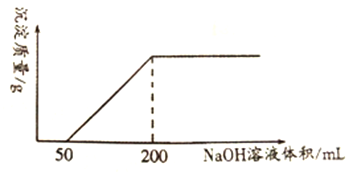
回答下列问题:
(1)写出铜与稀硝酸反应的离子方程式_____________________________________________。
(2)铜与稀硝酸反应中被还原HNO3的物质的量为________mol。
(3)铜与稀硝酸反应后的溶液中,H+的物质的量浓度为________mol/L(反应前后溶液体积变化忽略不计)。
(4)稀硝酸的物质的量浓度c=______mol/L。
(5)将铜与稀硝酸反应生成的NO通入NaOH 溶液中,并加入20%的H2O2水溶液使其全部转化为NaNO3,反应的化学方程式是______________________________________。
【答案】3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 0.05 0.5 2.5 2NO+2NaOH+3H2O2=2NaNO3+4H2O
【解析】
(1)铜和稀硝酸反应生成硝酸铜、NO和水;
(2)铜与稀硝酸反应中被还原HNO3反应后生成NO,由氮原子守恒来计算;
(3)反应结束后,向反应后的溶液中滴加1.0mol·L-1的NaOH溶液时,NaOH先和H+反应,将H+反应完后,再去和Cu2+反应,由图示,剩余的H+反应消耗50mLNaOH溶液;
(4)当加入氢氧化钠溶液200mL时,溶液中的H+、Cu2+反应完全,溶液中的溶质为NaNO3,据此求出溶液中n(NO3-),然后根据稀硝酸中n(HNO3)=n(NO3-)+n(NO)求出硝酸的物质的量,稀硝酸的浓度;
(5)将铜与稀硝酸反应生成的NO通入NaOH 溶液中,并加入20%的H2O2水溶液,则NO做还原剂被氧化为NaNO3,双氧水被还原。
(1)铜和稀硝酸反应生成硝酸铜、NO和水,故离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)铜与稀硝酸反应中被还原的HNO3反应后生成NO,而反应生成的NO的物质的量为0.05mol,根据1mol硝酸被还原则生成1molNO可知,被还原的硝酸为0.05mol;
(3)反应结束后,向反应后的溶液中滴加1.0mol·L-1的NaOH溶液时,NaOH先和H+反应,将H+反应完后,再去和Cu2+反应,根据图示可知,剩余的H+反应消耗50mLNaOH溶液,根据1molH+~1molNaOH可知,反应后的溶液中氢离子的物质的量n(H+)=n(NaOH)=cV=1mol·L-1×0.05L=0.05mol,则c(H+)=n(H+)/V=0.05mol÷0.1L=0.5mol·L-1;
(4)当加入氢氧化钠溶液200mL时,溶液中的H+、Cu2+反应完全,溶液中的溶质只有NaNO3,故溶液中的n(NO3-)=n(Na+)=n(NaOH)=1mol·L-1×0.2L=0.2mol,而原稀硝酸中n(HNO3)=n(NO3-)+n(NO)=0.2mol+0.05mol=0.25mol,故稀硝酸的浓度c=0.25mol÷0.1L=2.5mol·L-1;
(5)将铜与稀硝酸反应生成的NO通入NaOH 溶液中,并加入20%的H2O2水溶液,则NO做还原剂被氧化为NaNO3,双氧水被还原为H2O,故化学方程式为2NO+2NaOH+3H2O2=2NaNO3+4H2O。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】从实验测得不同物质中氧—氧之间的键长和键能的数据如下表:
O—O键 数据 | O | O | O2 | O |
键长/10-12m | 149 | 128 | 121 | 112 |
键能/kJ·mol-1 | x | y | z=494 | w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x。该规律性是( )
A. 成键时电子数越多,键能越大 B. 键长越短,键能越大
C. 成键所用的电子数越少,键能越小 D. 成键时电子对越偏移,键能越大