题目内容
【题目】已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为: ____________________________,
Y元素原子最外层电子的电子排布图为:____________________________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为____(填“共价键”或“离子键”)。
(3)该化合物的空间结构为____,中心原子的杂化类型为____,分子为____(填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____。
(5)该化合物的沸点与SiCl4比较:____(填化学式)的高,原因是_________。
【答案】 1s22s22p63s23p63d104s24p2 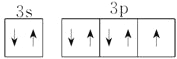 共价键 正四面体 sp3杂化 非极性分子 范德华力(或分子间作用力) GeCl4 组成和结构相似的分子晶体,相对分子质量越大,分子间作用力
共价键 正四面体 sp3杂化 非极性分子 范德华力(或分子间作用力) GeCl4 组成和结构相似的分子晶体,相对分子质量越大,分子间作用力
【解析】试题分析:与碳元素同主族的X元素位于周期表中的第1个长周期,则X应该是Ge元素。短周期元素Y原子的最外层电子数比内层电子总数少3,它们所形成化合物的分子式是XY4,所以Y应该是氯元素。
解析:(1)根据构造原理可知,Ge元素的原子基态时电子排布式为1s22s22p63s23p63d104s24p2。氯原子最外层电子的电子排布图为 。
。
(2)两种元素的电负性差小于1.7,所以XY4中X与Y之间的化学键为共价键。
(3)根据价层电子对互斥理论可知,分子中中心原子含有的价电子对数为![]() ,孤对电子对数是0,所以该分子是正四面体型结构,属于非极性分子。
,孤对电子对数是0,所以该分子是正四面体型结构,属于非极性分子。
(4)XY4在常温下为液体,说明该化合物形成的晶体类型是分子晶体,所以该化合物中存在的微粒间作用力有共价键、范德华力。
(5)由于二者结构相似,形成的晶体类型都是分子晶体,但GeCl4相对分子质量大,范德华力强,所以GeCl4熔、沸点高。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案