题目内容
【题目】从实验测得不同物质中氧—氧之间的键长和键能的数据如下表:
O—O键 数据 | O | O | O2 | O |
键长/10-12m | 149 | 128 | 121 | 112 |
键能/kJ·mol-1 | x | y | z=494 | w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x。该规律性是( )
A. 成键时电子数越多,键能越大 B. 键长越短,键能越大
C. 成键所用的电子数越少,键能越小 D. 成键时电子对越偏移,键能越大
【答案】B
【解析】A. 由表中数据可知成键时电子数越多,键能越小,故A不符合题意;B. 由表中数据可知键长越短,键能越大,故B符合题意;C. 由表中数据可知成键所用的电子数越少,键能越大,故C不符合题意;D. 本题成键时电子对处于相同元素原子氧原子之间,电子对不偏移,故D不符合题意。故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
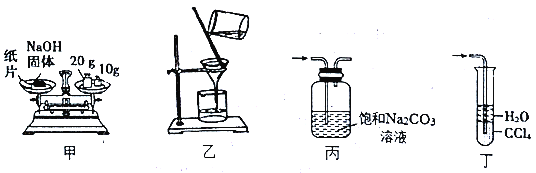
【题目】速力菲的主要成分是琥珀酸亚铁,是一种常见的补铁药物。某同学为检测速力菲中Fe2+的存在,设计并进行实验如下:
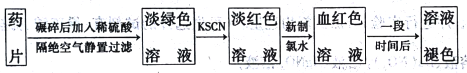
回答下列问题:
(1)实验中碾碎药片需要的仪器是____________。
(2)加KSCN溶液后,溶液呈淡红色,其原因可能是___________。加入新制氯水后,发生反应的离子方程式为_________________。
(3)放置一段时间后,溶液的颜色会逐渐褪去。请对溶液褪色的原因作出2种猜想:
编号 | 猜想 |
甲 | ______ |
乙 | _______ |
(4)医学上服用维生素C,可防止二价亚铁离子被氧化,由此推测维生素C具有______性。
(5)正常人每天应补充14mg左右的铁,其中绝大部分来自于食物。如果全部通过服用含FeS04·7H2O的片剂来补充铁,则正常人每天需服用含_____mgFeSO4·7H2O的片剂。