题目内容
【题目】滴定是一种化学实验操作也是一种定量分析的手段。它通过两种溶液的定量反应来确定某种溶质的含量。实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,其操作过程为:
①准确称取2.040g邻苯二甲酸氢钾加入250mL锥形瓶中;
②向锥形瓶中加30mL蒸馏水溶解;
③向溶液中加入1~2滴指示剂;
④用氢氧化钠溶液滴定至终点;
⑤重复以上操作;
⑥根据两次实验数据计算氢氧化钠的物质的量的浓度。
已知:Ⅰ、到达滴定终点时,溶液的pH值约为9.1。
Ⅱ、邻苯二甲酸氢钾在水溶液中可以电离出一个H+
Ⅲ、邻苯二甲酸氢钾的相对分子质量为204
指示剂 | 酚酞 | 甲基橙 | ||||
pH范围 | <8.2 | 8.2 ~ 10 | >10 | <3.1 | 3.1 ~ 4.4 | >4.4 |
颜色 | 无色 | 粉红色 | 红色 | 红色 | 橙色 | 黄色 |
(1)为标定氢氧化钠溶液的浓度,应选用___________作指示剂;
(2)判断到达滴定终点的实验现象是___________________________________________;
(3)滴定结束消耗NaOH溶液体积为10.00ml,则NaOH溶液的浓度为______________;
(4)滴定过程中,下列操作能使测定结果(待测液的浓度数值)偏小的是_________。
A.上述操作中,将邻苯二甲酸氢钾直接放入锥形瓶中溶解
B.滴定管在滴定开始时尖嘴有气泡,滴定完成时气泡消失
C.滴定完毕,尖嘴外留有液滴或溶液滴在锥形瓶外
D.滴定前仰视读数而滴定终了俯视读数
【答案】酚酞 溶液由无色变为浅红色,且在半分钟内不褪色 1 mol/L BC
【解析】
(1)已知到达滴定终点时,溶液的pH值约为9.1,根据指示剂的变色范围进行分析;
(2)选用酚酞作指示剂,滴定前溶液为无色,当到达滴定终点时溶液的颜色为浅红色,据此判断滴定终点;
(3)由n=![]() 计算邻苯二甲酸氢钾的物质的量,再根据n(KHC8H4O4)=n(NaOH)以及c=
计算邻苯二甲酸氢钾的物质的量,再根据n(KHC8H4O4)=n(NaOH)以及c=![]() 进行计算;
进行计算;
(4)根据不当操作对c(待测)=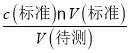 进行误差分析
进行误差分析
(1)已知到达滴定终点时,溶液的pH值约为9.1,根据指示剂的变色范围可知应选择的指示剂为酚酞;
(2)选用酚酞作指示剂,滴定前溶液为无色,当到达滴定终点时溶液的颜色为浅红色,且在半分钟内不褪色;
(3)n(邻苯二甲酸氢钾)=![]() =
=![]() =0.01mol,由n(KHC8H4O4)=n(NaOH)可知n(NaOH)= 0.01mol,c=
=0.01mol,由n(KHC8H4O4)=n(NaOH)可知n(NaOH)= 0.01mol,c=![]() =
=![]() =1mol/L;
=1mol/L;
(4)A.将邻苯二甲酸氢钾在锥形瓶中溶解,不影响滴定的结果,A项错误;
B. 滴定管在滴定开始时尖嘴有气泡,滴定完成时气泡消失,会使消耗的待测液体积偏大,则测定结果偏小,B项正确;
C.滴定结束,尖嘴外留有液滴或溶液滴在锥形瓶外,会使消耗的待测液的体积偏大,则测定结果偏小,C项正确;
D. 滴定前仰视读数而滴定终了俯视读数,导致读出的待测液体积偏小,测定结果偏大,D项错误;
答案选BC。

【题目】中国古代炼丹术中蕴含了丰富的化学知识,相关记载不绝于书。下列对炼丹术中相关记载的原理解释不正确的是
选项 | 相关记载 | 解释 |
A. | 《抱朴子》:“曾青(CuSO4)涂铁,铁赤色如铜……外变而内不化也。” | 发生了铁置换铜单质的反应 |
B. | 《吕氏春秋别类编》:“金(古代的‘金’往往指铜)柔锡柔,合两柔则刚。” | 合金的硬度大于组成它的纯 金属的硬度 |
C. | 《抱朴子》:“丹砂(HgS)烧之成水银,积变又还成丹砂。” | 发生了可逆反应:HgS |
D. | 《周易参同契》:“胡粉[2PbCO3·Pb(OH)2]投火中,色坏还为铅(Pb)。” | 此处的“火”中含有炭,将 胡粉发生分解反应生成的铅的氧化物还原为单质铅。 |
A.A B.BC.CD.D