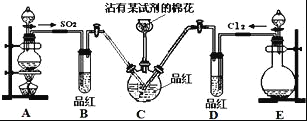
ЬтФПФкШн
ЁОЬтФПЁПQЁЂRЁЂXЁЂYЁЂZЮхжждЊЫиЕФдзгађЪ§вРДЮЕндіЁЃвбжЊЃКЂйZЕФдзгађЪ§ЮЊ26ЃЌЦфгрЕФОљЮЊЖЬжмЦкжїзхдЊЫиЃЛЂкYдзгМлЕчзгЃЈЭтЮЇЕчзгЃЉХХВМmsnmpn ЂлRдзгКЫЭтLВуЕчзгЪ§ЮЊЦцЪ§ЃЛЂмQЁЂXдзгpЙьЕРЕФЕчзгЪ§ЗжБ№ЮЊ2КЭ4ЁЃЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉR3- ЕФКЫЭтЕчзгХХВМЪНЪЧ____________________________ЃЛ
ЃЈ2ЃЉаДГіZ(OH)3МгШШЕФЛЏбЇЗНГЬЪН_________________________ЃЛ
ЃЈ3ЃЉQгыYаЮГЩЕФзюМђЕЅЦјЬЌЧтЛЏЮяЗжБ№ЮЊМзЁЂввЃЌЯТСаХаЖЯе§ШЗЕФЪЧ________ЃЌ
aЃЎЮШЖЈадЃКМз>ввЃЌЗаЕуЃКМз>вв bЃЎЮШЖЈадЃКМз>ввЃЌЗаЕуЃКМз<вв
cЃЎЮШЖЈадЃКМз<ввЃЌЗаЕуЃКМз<вв dЃЎЮШЖЈадЃКМз<ввЃЌЗаЕуЃКМз>вв
ЃЈ4ЃЉQЁЂRЁЂYШ§жждЊЫиЕФдзгАыОЖДгДѓЕНаЁЕФЫГађЮЊ____________ЃЈгУдЊЫиЗћКХзїД№ЃЉ
ЃЈ5ЃЉQЕФвЛжжЧтЛЏЮяЯрЖдЗжзгжЪСПЮЊ26ЃЌЦфЕчзгЪНЮЊ__________________
ЃЈ6ЃЉXКЭYаЮГЩЕФЛЏКЯЮяОЇЬхЪєгк____________ЁЃ
ЁОД№АИЁП1S22S22P6 ![]() b Si ЃО C ЃО N HЁУCЉЋЉЋCЁУH дзгОЇЬх
b Si ЃО C ЃО N HЁУCЉЋЉЋCЁУH дзгОЇЬх
ЁОНтЮіЁП
ZЕФдзгађЪ§ЮЊ26ЃЌдђZЮЊFeдЊЫиЃЛQЁЂRЁЂXЁЂYОљЮЊЖЬжмЦкжїзхдЊЫиЃЌQЁЂRЁЂXЁЂYЁЂZЮхжждЊЫиЕФдзгађЪ§вРДЮЕндіЁЃQЁЂXЕФpЙьЕРЮЊ2КЭ4ЃЌЖўепга2ИіЕчзгВуЃЌдђЮЊQЮЊCдЊЫиКЭXЮЊOдЊЫиЃЛYдзгМлЕчзгЃЈЭтЮЇЕчзгЃЉХХВМmsnmpnЃЌsФмМЖШнФЩЕчзгЪ§ЮЊ2ЃЌдђYПЩФмЮЊCЛђSiЃЌгЩгкQЮЊCдЊЫиЃЌЫљвдYЮЊSiдЊЫиЃЛRЕФКЫЭтLВуЮЊЦцЪ§ЃЌЫљвдRга2ИіЕчзгВуЃЌдђПЩФмЮЊLiЁЂBЁЂNЛђFЃЌRЕФдзгађЪ§НщгкQгыXжЎМфЃЌQЮЊCдЊЫиЃЌXЮЊOдЊЫиЃЌдђRЮЊNдЊЫиЁЃЫљвдПЩЭЦГіЃКQЮЊCЃЌRЮЊNЃЌXЮЊOЃЌYЮЊSiЃЌZЮЊFeЃЌОнДЫД№ЬтЁЃ
ЃЈ1ЃЉдђRЮЊNдЊЫиЃЌN3-КЫЭтЕчзгХХВМЪНЮЊЃК1S22S22P6ЃЌЙЪД№АИЮЊЃК1S22S22P6ЃЛ
ЃЈ2ЃЉZЮЊFeЃЌFe (OH)3МгШШЕФЛЏбЇЗНГЬЪНЮЊЃК![]() ,ЙЪД№АИЮЊЃК
,ЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
ЃЈ3ЃЉQЁЂYЕФЧтЛЏЮяЗжБ№ЮЊCH4КЭSiH4ЃЌгЩгкCЕФЗЧН№ЪєадЧПгкSiЃЌдђЮШЖЈадCH4ЃОSiH4ЃЎвђЮЊSiH4ЕФЯрЖдЗжзгжЪСПБШCH4ДѓЃЌЙЪЗжзгМфзїгУСІДѓЃЌЗаЕуИпЃЌЙЪД№АИЮЊЃКbЃЛ
ЃЈ4ЃЉQЮЊCЃЌRЮЊNЃЌ YЮЊSiЃЌCЁЂNКЭSiжаЃЌCЁЂSiЮЛгкЭЌвЛжїзхЃЌSiЕФдзгАыОЖДѓгкCЃЌCЁЂNЮЛгкЭЌвЛжмЦкЃЌCЕФАыОЖДѓгкNЃЌЙЪдзгАыОЖДгДѓЕНаЁЕФЫГађЮЊЃКSi ЃО C ЃО NЃЌЙЪД№АИЮЊЃКSi ЃО C ЃО NЃЛ
ЃЈ5ЃЉCЁЂHаЮГЩЕФЯрЖдЗжзгжЪСПЮЊ26ЕФЮяжЪЮЊC2H2ЃЌЦфЕчзгЪНЮЊЃКHЁУCЉЋЉЋCЁУHЃЌЙЪД№АИЮЊЃКHЁУCЉЋЉЋCЁУHЃЛ
ЃЈ6ЃЉXЮЊOЃЌYЮЊSiЃЌСНепЙЙГЩЕФSiO2ЃЌЙЙГЩЮЂСЃЪЧдзгЃЌзїгУСІЪЧЙВМлМќЃЌдђЪєгкдзгОЇЬхЃЌЙЪД№АИЮЊЃКдзгОЇЬхЁЃ

 УћаЃПЮЬУЯЕСаД№АИ
УћаЃПЮЬУЯЕСаД№АИЁОЬтФПЁПЯрЭЌЮТЖШЁЂЯрЭЌШнЛ§ЕФЫФИіУмБеШнЦїжаНјааЭЌбљЕФПЩФцЗДгІЃК2X(g)+Y(g)![]() 3W(g)+2Z(g) ЁїH=ЉQ KJ/molЃЌЦ№ЪМЪБГфШыЦјЬхЕФЮяжЪЕФСПМАЦНКтЪБЬхЯЕФмСПБфЛЏЪ§ОнШчБэЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
3W(g)+2Z(g) ЁїH=ЉQ KJ/molЃЌЦ№ЪМЪБГфШыЦјЬхЕФЮяжЪЕФСПМАЦНКтЪБЬхЯЕФмСПБфЛЏЪ§ОнШчБэЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
X | Y | W | Z | ЗДгІЬхЯЕФмСПБфЛЏ | |
Мз | 2mol | 1mol | ЗХГіa kJ/mol | ||
вв | 1mol | 1mol | ЗХГіb kJ/mol | ||
Бћ | 2mol | 2mol | ЗХГіc kJ/mol | ||
ЖЁ | 3mol | 2mol | ЮќЪеd kJ/mol |
A.XЕФзЊЛЏТЪЮЊЃКМзЃМввЃМБћ
B.c+dЃМQ
C.ЦНКтЪБЃЌМзШнЦїжаЕФЗДгІЫйТЪБШЖЁШнЦїжаЕФТ§
D.ЦНКтЪББћШнЦїжаZЕФЮяжЪЕФСПХЈЖШзюДѓ