题目内容
【题目】下列叙述中正确的是( )
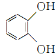
A.向稀苯酚溶液中加入少量稀溴水,无现象,是因为不能发生取代反应
B.实验室进行石油的蒸馏、乙酸乙酯的制取、乙烯的制取实验时均需要使用温度计
C.将红热的铜丝迅速插入乙醇中,反复多次,可观察到铜丝表面变黑,并能闻到香味
D.用强光照射盛有CH4与Cl2(体积比1:4)的集气瓶后,可观察到瓶内壁附有油状物
【答案】D
【解析】
A.将少量溴水滴入苯酚溶液中,由于苯酚和稀溴水不反应,所以没有现象,浓溴水与苯酚发生取代反应生成三溴苯酚白色沉淀和溴化氢,故A错误;
B.石油分馏时所用温度计的位置放在蒸馏烧瓶的支管口处,测量馏分的沸点,乙烯的制取,乙醇在170℃时生成乙烯,需用温度计控制温度,乙酸乙酯的制取无需使用温度计,故B错误;
C.铜丝放在酒精灯外焰加热与氧气反应生成氧化铜,铜丝变黑;加热过的铜丝插入盛有乙醇的试管中,氧化铜与乙醇反应生成乙醛与铜,恢复原来的红色,同时生成具有香味的乙醛,反应方程式为2CH3CH2OH+O2![]() 2CH3CHO+H2O,故C错误;
2CH3CHO+H2O,故C错误;
D.用强光照射盛有CH4与Cl2(体积比1:4)的集气瓶后,4Cl2+CH4![]() CCl4+4HCl,四氯化碳为无色油状有机物,所以可观察到瓶内壁附有油状物,故D正确。
CCl4+4HCl,四氯化碳为无色油状有机物,所以可观察到瓶内壁附有油状物,故D正确。
答案:D。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
| C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ||
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:
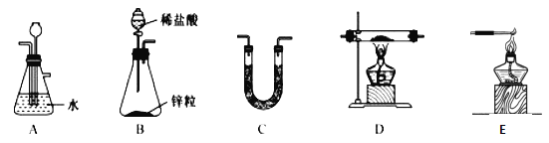
①H2还原无水FeCl3制取FeCl2的化学方程式为_____________。
②按气流由左到右的方向,上述仪器的连接顺序为_________(填字母,装置可多次使用);C中盛放的试剂是_____________。
③该制备装置的缺点为________________。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
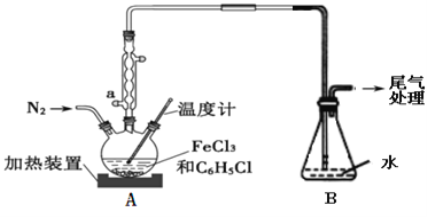
①仪器a的名称是__________。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____,回收滤液中C6H5C1的操作方法是______。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:________(写出一点即可)。
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如图所示:
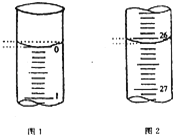
(1)所用盐酸溶液的体积为________mL
(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,用酚酞做指示剂,达到滴定终点的现象是:_____
(3)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000molL-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据列出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=_______
(4)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是_______(填写编号)。
A.中和滴定达终点时俯视滴定管内液面读数。
B.碱式滴定管用蒸馏水洗净后立即取用25.00mL待测碱溶液注入锥形瓶进行滴定。
C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定。
D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后用来滴定。