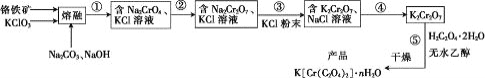
题目内容
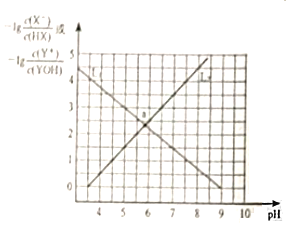
【题目】室温下,用0.100molL-1NaOH溶液分别滴定20.00mL0.100molL-1的HA和HB两种酸溶液,滴定曲线如图所示[已知AG=lg![]() ],下列说法不正确的是( )
],下列说法不正确的是( )

A.P点时,加入NaOH溶液的体积为20.00mL
B.Ka(HB)的数量级为10-4
C.水的电离程度:N>M=P
D.M、P两点对应溶液中存在:c(A-)=c(B-)
【答案】D
【解析】
未加NaOH溶液时,HA的AG=12,则c(H+)c(OH-)=10-14,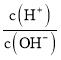 =10-12,则c(H+)=0.1mol/L=c(HA),HA是强酸;
=10-12,则c(H+)=0.1mol/L=c(HA),HA是强酸;
未加NaOH溶液时,HB的AG=9,则c(H+)c(OH-)=10-14,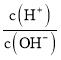 =10-9,则c(H+)=10-2.5mol/L<0.1mol/L,则HB是弱酸;
=10-9,则c(H+)=10-2.5mol/L<0.1mol/L,则HB是弱酸;
A.P点AG=0时,c(H+)=c(OH-),混合溶液呈中性,HA是强酸,酸碱的物质的量相等,酸碱的物质的量浓度相等,则酸碱体积相等,所以加入NaOH溶液的体积为20.00mL,故A正确;
B.HB的电离程度较小,则溶液中c(B-)≈c(H+)=10-2.5mol/L,c(HB)≈0.1mol/L,Ka(HB)=![]() =
=![]() =10-4,故B正确;
=10-4,故B正确;
C.酸或碱抑制水电离,弱离子促进水电离,且酸中c(H+)越大其抑制水电离程度越大,M、P点溶液都呈中性,则M、P点不影响水的电离,N点NaB浓度较大,促进水电离,所以水的电离程度:N>M=P,故C正确;
D.M、P点的AG都为0,都存在c(H+)=c(OH-),混合溶液呈中性,加入的NaOH越多,c(Na+)越大,溶液中存在电荷守恒,则存在P点c(A-)=c(Na+)、M点c(Na+)=c(B-),但是c(Na+):M<P点,则c(A-)>c(B-),故D错误;
答案选D。

练习册系列答案
相关题目