题目内容
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+196 kJ·mol-1
2NO(g) ΔH=+196 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-554 kJ·mol-1
2CO2(g) ΔH=-554 kJ·mol-1
(1)请写出NO和CO转变为两种无毒无害的物质的热化学方程式_______________。
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO物质的量随时间变化如图所示。
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=30MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
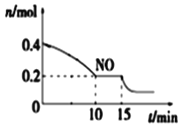
②15 min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____(填序号)
A.升温 B.增大CO浓度 C.加入催化剂 D.减小容器体积
(3)在373K时,向体积为2L的恒容真空容器中通入0.40molNO2,发生反应:2NO2(g)![]() N2O4(g) ΔH=57.0kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=57.0kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20min内,v(N2O4)=_________________。
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为__________。
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分別在阴、阳极转化为乙醇和乙酸,总反应为2 CH3CHO+H2O![]() CH3CH2 OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
CH3CH2 OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示
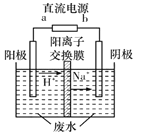
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分別为4OH--4e-=O2↑+2H2O、__________________。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分別注入1m3乙醛的含量为300mg/L的废水,可得到乙醇_______kg(计算结果保留2位小数)。
【答案】2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-750 kJ·mol-1 0.0583 (或7/120) 不 BD 2.0×10-3mol·L1·min1 k1=60k2 CH3CHO- 2e-+H2O=CH3COOH+2H+ 0.19
2CO2(g)+N2(g) ΔH=-750 kJ·mol-1 0.0583 (或7/120) 不 BD 2.0×10-3mol·L1·min1 k1=60k2 CH3CHO- 2e-+H2O=CH3COOH+2H+ 0.19
【解析】
Ⅰ.已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+196 kJ·mol-1 ①
2NO(g) ΔH=+196 kJ·mol-1 ①
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-554 kJ·mol-1 ②
2CO2(g) ΔH=-554 kJ·mol-1 ②
(1)利用盖斯定律,将②-①即可得出NO和CO转变为两种无毒无害的物质的热化学方程式;
(2)① 采集图中数据,可建立如下三段式关系:

p(NO)=p(CO)=p(CO2)=![]() ×30MPa,p(N2)=
×30MPa,p(N2)=![]() ×30MPa,Kp=
×30MPa,Kp=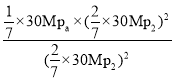 ;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,利用浓度商与K进行比较,确定平衡移动的方向;
;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,利用浓度商与K进行比较,确定平衡移动的方向;
②从图中可以看出,改变条件后,平衡将正向移动,由此可通过对条件的分析,确定改变的反应条件;
(3)① 0~20min内,设NO2的变化量为2x,从而建立三段式;
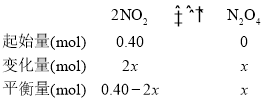
![]() ,x=0.08mol,从而求出v(N2O4)。
,x=0.08mol,从而求出v(N2O4)。
② 0~60min内,设NO2的变化量为2y,从而建立三段式;
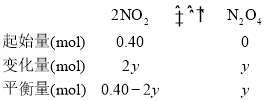
![]() ,y=0.15mol,K=
,y=0.15mol,K=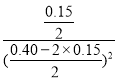 =30,平衡时v正(NO2)= 2v逆(N2O4),代入公式,即可求出373K时,k1、k2的数学关系式;
=30,平衡时v正(NO2)= 2v逆(N2O4),代入公式,即可求出373K时,k1、k2的数学关系式;
(4)①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分別为4OH--4e-=O2↑+2H2O、乙醛得电子转化为乙醇等;
② m(CH3CHO)=1000L×0.300g/L×60%=180g,由CH3CHO——CH3CH2OH,可得到乙醇的质量;
Ⅰ.已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+196 kJ·mol-1 ①
2NO(g) ΔH=+196 kJ·mol-1 ①
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-54 kJ·mol-1 ②
2CO2(g) ΔH=-54 kJ·mol-1 ②
(1)利用盖斯定律,将②-①即可得出热化学方程式2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-750 kJ·mol-1;答案为:2NO(g)+2CO(g)
2CO2(g)+N2(g) ΔH=-750 kJ·mol-1;答案为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-750 kJ·mol-1;
2CO2(g)+N2(g) ΔH=-750 kJ·mol-1;
(2)① 采集图中数据,可建立如下三段式关系:

p(NO)=p(CO)=p(CO2)=![]() ×30MPa,p(N2)=
×30MPa,p(N2)=![]() ×30MPa,Kp=
×30MPa,Kp=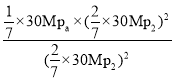 =0.0583 (或7/120);平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,原平衡时,c(NO)=c(CO2)=0.2mol,现c(NO)=c(CO2)=0.5mol,则浓度商Q与K必然相等,所以平衡不移动;答案为:0.0583 (或7/120);不;
=0.0583 (或7/120);平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,原平衡时,c(NO)=c(CO2)=0.2mol,现c(NO)=c(CO2)=0.5mol,则浓度商Q与K必然相等,所以平衡不移动;答案为:0.0583 (或7/120);不;
②从图中可以看出,改变条件后,平衡将正向移动。
A.升温,平衡逆向移动,A不合题意;
B.增大CO浓度,平衡正向移动,B符合题意;
C.加入催化剂,平衡不发生移动,C不合题意;
D.减小容器体积,平衡正向移动,D符合题意。答案为:BD;
(3)① 0~20min内,设NO2的变化量为2x,从而建立三段式;
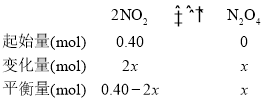
![]() ,x=0.08mol,从而求出v(N2O4)=
,x=0.08mol,从而求出v(N2O4)=![]() =2.0×10-3mol·L1·min1。答案为:2.0×10-3mol·L1·min1;
=2.0×10-3mol·L1·min1。答案为:2.0×10-3mol·L1·min1;
② 0~60min内,设NO2的变化量为2y,从而建立三段式;
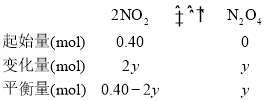
![]() ,y=0.15mol,K=
,y=0.15mol,K=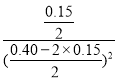 =30,平衡时v正(NO2)= 2v逆(N2O4),代入公式,即k1·c2(NO2) =2k2·c(N2O4),k1=2K×k2=60k2;答案为:k1=60k2;
=30,平衡时v正(NO2)= 2v逆(N2O4),代入公式,即k1·c2(NO2) =2k2·c(N2O4),k1=2K×k2=60k2;答案为:k1=60k2;
(4)①阳极电极反应分別为4OH--4e-=O2↑+2H2O、CH3CHO- 2e-+H2O=CH3COOH+2H+;答案为:CH3CHO- 2e-+H2O=CH3COOH+2H+;
② m(CH3CHO)=1000L×0.300g/L×60%=180g,由CH3CHO——CH3CH2OH,可得到乙醇的质量为![]() =188g0.19kg;答案为:0.19。
=188g0.19kg;答案为:0.19。