题目内容
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答下列问题:
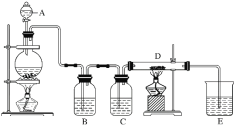
(1)仪器A的名称是________,烧瓶中反应的化学方程式是___________。
(2)装置B中盛放液体是_______,气体通过装置B的目的是___________。
装置C中盛放的液体是________,气体通过装置C的目的是____________。
(3)D中反应的化学方程式是__________________。
(4)烧杯E中盛放的液体是________,反应的化学方程式是_____________。
【答案】分液漏斗 4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O 饱和NaCl溶液 吸收氯气中混有的杂质HCl 浓硫酸 吸收水蒸气,干燥氯气 2Fe+3Cl2
MnCl2+Cl2↑+2H2O 饱和NaCl溶液 吸收氯气中混有的杂质HCl 浓硫酸 吸收水蒸气,干燥氯气 2Fe+3Cl2![]() 2FeCl3 NaOH溶液 2NaOH+Cl2=NaCl+NaClO+H2O
2FeCl3 NaOH溶液 2NaOH+Cl2=NaCl+NaClO+H2O
【解析】
在加热的条件下把浓盐酸滴入二氧化锰反应生成氯气,生成的氯气中含杂质氯化氢和水蒸气,通过装置B中的饱和食盐水除去氯化氢,通过装置C中的浓硫酸除去水蒸气,干燥的氯气进入装置D和铁加热反应生成氯化铁,剩余氯气通入氢氧化钠溶液吸收,据此解答。
(1)由装置图可知仪器A的名称为分液漏斗,在加热的条件下二氧化锰氧化浓盐酸生成氯气,则烧瓶中发生反应的化学方程式为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)反应生成的氯气中含有氯化氢和水蒸气杂质气体,氯化氢极易溶于水,氯气在饱和食盐水中溶解性很小,通过饱和食盐水除去氯化氢气体,通过浓硫酸吸收水蒸气,装置B中盛放液体是饱和食盐水,气体通过装置B的目的是吸收氯气中混有的杂质HCl,装置C中盛放的液体是浓硫酸,气体通过装置C的目的是吸收水蒸气,干燥氯气。
(3)D中氯气和铁在加热的条件下反应生成氯化铁,反应的化学方程式是2Fe+3Cl2![]() 2FeCl3。
2FeCl3。
(4)氯气有毒,不能排放到空气中,装置E中盛放的是氢氧化钠溶液,用来吸收未反应的氯气,防止污染空气,氯气与NaOH溶液反应的化学方程式是2NaOH+Cl2=NaCl+NaClO+H2O。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =__________________。
(2)该反应为__________反应(“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):

(1)铬铁矿(FeCr2O4)改写为氧化物的形式为___________________。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
(3)写出反应②中生成固体B的离子方程式为_________________________________。
(4)pH < 5时,发生反应有__________________(写离子方程式),Na2Cr2O7 + 2KCl = K2Cr2O7↓+ 2NaCl。
下表是相关物质的溶解度数据:
物质 | 溶解度 | ( g / 100 g H2O ) | |
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
①加入KCl固体后经一系列操作析出K2Cr2O7晶体的理由是___________________________。
②获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)某种酒精测试仪中,K2Cr2O7在酸性条件下将乙醇氧化为乙酸,自身被还原为三价铬离子,该反应的氧化剂与还原剂的物质的量比为_________________。
(6)含铬废渣(废水)的随意排放对人类生成环境有极大的危害,电解法是处理铬污染的一种方法,电解时,在阴极区有Fe(OH)3和Cr(OH)3