题目内容
10.实验室常用二氧化锰和浓盐酸反应制备氯气,用如图装置可制备纯净、干燥的氯气,并验证其部分性质.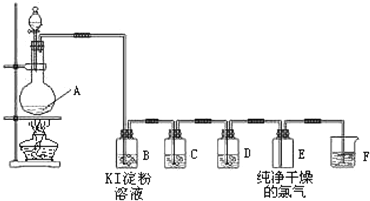
试回答下列问题:
(1)A中发生反应的化学方程式是MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O.
(2)C、D中所用试剂分别是:C饱和食盐水;D浓硫酸.
(3)B中出现的现象是溶液颜色由无色变为蓝色.
(4)请用离子方程式表示F中NaOH溶液的作用Cl2+2OH-═Cl-+ClO-+H2O.
(5)若想制得标准状况下2.24L氯气,理论上被氧化的HCl的物质的量是0.2mol.
分析 (1)实验室用浓盐酸与二氧化锰加热制取氯气;
(2)从发生装置中制取的氯气含有氯化氢,水蒸气,要制取纯净的氯气,应除去氯化氢和水蒸气,氯气在饱和食盐水中溶解度小,可以降低氯气的溶解度,同时除去氯化氢杂质,浓硫酸具有吸水性,能够干燥氯气;
(3)氯气具有强的氧化性,能够氧化碘离子生成单质碘;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(5)根据反应方程式中化合价的变化判断被氧化的HCl的物质的量.
解答 解:(1)浓盐酸与二氧化锰加热反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O;
故答案为:MnO2+4HCl $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O;
(2)氯化氢极易溶于水,氯气在饱和食盐水中溶解度不大,可以饱和食盐水除去氯化氢;浓硫酸具有吸水性,可以干燥氯气;
故答案为:饱和食盐水;浓硫酸;
(3)氯气与碘离子发生氧化反应生成单质碘,碘遇到淀粉变蓝色;
故答案为:溶液颜色由无色变为蓝色;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2 OH-═Cl-+ClO-+H2O;
故答案为:Cl2+2 OH-═Cl-+ClO-+H2O;
(5)依据方程式MnO2+4HCl $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O可知,生成1mol氯气,转移2mol电子,生成标准状况下2.24L氯气,物质的量为0.1mol,转移电子为0.2mol,
故答案为:0.2.
点评 本题考查了氯气的制取方法,涉及了气体的制取原理、实验除杂的方法选择和试剂作用、尾气的处理等知识,题目难度不大,计算时注意依据化合价变化数目.

 阅读快车系列答案
阅读快车系列答案| A. | 钠 | B. | 镁 | C. | 铝 | D. | 硅 |
| A. | 二者都能水解,且水解的最终产物相同 | |
| B. | 它们都可用(C6H10O5)n表示,所以二者互为同分异构体 | |
| C. | 它们均属于糖类,都具有甜味,且都是高分子化合物 | |
| D. | 淀粉能发生银镜反应,而纤维素不能,但能发生酯化反应 |
①中子数 ②质子数 ③核电荷数 ④质量数 ⑤核外电子数.
| A. | ①②③ | B. | ①③⑤ | C. | ②③④ | D. | ②③⑤ |
| A. | 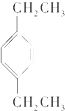 | B. | 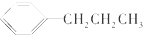 | C. | 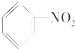 | D. | 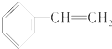 |
| A. | 乙二醇用于汽车防冻液 | |
| B. | 麦芽糖在水解前后均能发生银镜反应 | |
| C. | 1-氯丙烷和2-氯丙烷发生消去反应的产物不同 | |
| D. | H2N-CH2-COOH的缩聚产物中含  结构 结构 |
 ,若分子中的两个氢原子被溴原子取代后有多种对称产物,如
,若分子中的两个氢原子被溴原子取代后有多种对称产物,如
 、
、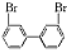 、
、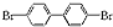 ;
;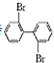 与
与 的相互关系是B.
的相互关系是B.