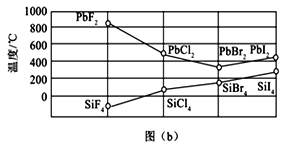
题目内容
【题目】胶体是一种常见的分散系,回答下列问题。
(1)向煮沸的蒸馏水中逐滴加入____________溶液,继续煮沸至__________________,停止加热,可制得Fe(OH)3胶体。
(2)向Fe(OH)3胶体中加入Na2SO4饱和溶液,主要由于________(填离子符号)的作用,使胶体形成了沉淀,这个过程叫作________________。
(3)区分胶体和溶液常用的方法叫作______________,这是因为胶体粒子对光线的________作用而形成的
【答案】滴饱和氯化铁溶液 液体呈红褐色 SO![]() 聚沉 丁达尔效应(或丁达尔现象) 散射
聚沉 丁达尔效应(或丁达尔现象) 散射
【解析】
(1)、制取氢氧化铁胶体的方法为:向煮沸的蒸馏水中逐滴加入饱和氯化铁溶液溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体,故答案为:饱和氯化铁溶液;液体呈红褐色;
(2)、向Fe(OH)3胶体中加入Na2SO4饱和溶液,由于硫酸根离子中和了氢氧化铁胶粒的电荷,导致胶体发生了聚沉,故答案为:SO42;聚沉;
(3)、胶体具有丁达尔效应,据此可以区分胶体和溶液,胶体的丁达尔效应是胶体粒子对光线的散射作用形成的,
故答案为:丁达尔效应(或丁达尔现象);散射。

【题目】已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 | H2SO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
(1)25℃时,将20mL 0.1mol·L-1CH3COOH溶液和20mL 0.1mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:__________________________
(2)若保持温度不变,在CH3COOH溶液中加入一定量氨气,下列量会变小的是____(填序号)
A.c(CH3COO-) B.c(H+)C.Kw D.醋酸电离平衡常数
(3)若保持温度不变,将pH均为3的HCl与HSCN的溶液分别加水稀释100倍,此时c(Cl-)_____c(SCN-) (填“>、=、<”,后同),两溶液的导电性:HCl _______HSCN
(4)将足量的NaHSO3溶液加入Na2CO3溶液中,反应的离子方程式为___________________________