题目内容
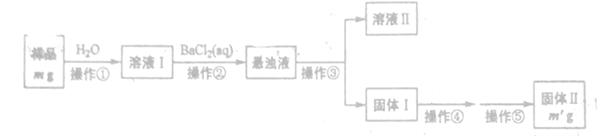
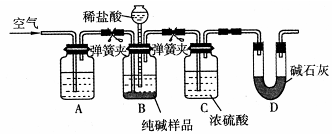
碳酸钙常用作牙膏的摩擦剂.某同学设计了一种制备碳酸钙的方案,其流程图如下:(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨.标准状况下生成二氧化碳的体积为 L,石灰石中碳酸钙的质量分数为 %.
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶性滤渣的成分为 .
(3)第③步反应一般不采用通入CO2的主要原因是 ,相应的离子方程式为 .
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是 .
(5)某学生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:

与前一方案相比较,该方案的优点是 .

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨.标准状况下生成二氧化碳的体积为 L,石灰石中碳酸钙的质量分数为 %.
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶性滤渣的成分为 .
(3)第③步反应一般不采用通入CO2的主要原因是 ,相应的离子方程式为 .
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是 .
(5)某学生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:

与前一方案相比较,该方案的优点是 .
(每空2分,共14分)
(1)2.24×107L ; 90.0 (4分)
(2)CaSiO3 (2分)
(3)通入CO2的量不易控制,使生成的碳酸钙在CO2过量的条件下溶解 (2分)
CaCO3+CO2+H2O=Ca2++2HCO3— (2分)
(4)5.6×105mol/L (2分)
(5)不需要加热,操作简单,减少来自燃料的污染(2分)
(1)2.24×107L ; 90.0 (4分)
(2)CaSiO3 (2分)
(3)通入CO2的量不易控制,使生成的碳酸钙在CO2过量的条件下溶解 (2分)
CaCO3+CO2+H2O=Ca2++2HCO3— (2分)
(4)5.6×105mol/L (2分)
(5)不需要加热,操作简单,减少来自燃料的污染(2分)
试题分析:
(1)
 根据碳酸钙分解:
根据碳酸钙分解:CaCO3
 CaO + CO2 ↑ △m
CaO + CO2 ↑ △m100 56 22.4 44
100×106g V 44×106g
所以生成二氧化碳的体积为
 mol×22.4L/mol=2.24×107L
mol×22.4L/mol=2.24×107L石灰石中碳酸钙的质量分数为
 ×100%=90.9%
×100%=90.9%(2)碳酸钙除了分解,还与少量杂质SiO2发生反应:SiO2+CaCO3=CaSiO3+CO2
所以不溶液性滤渣的成分有CaSiO3。
(3)因CO2过量时,会继续与碳酸钙反应,CaCO3+CO2+H2O═Ca2++2HCO3-(4)当溶液中QC≥KSP时,形成沉淀,C(Ca2+)≥
 mol?L-1=2.8×10-5mol?L-1,
mol?L-1=2.8×10-5mol?L-1,等体积混合前CaCl2溶液的物质的量浓度最小为5.6×10-5 mol?L-1
(5)因与前一方案相比较,可知制备过程不需要加热、操作简便等。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
 萃取碘水中的碘
萃取碘水中的碘