题目内容
某Na2CO3样品中混有一定量的Na2SO4 (设均不含结晶水),某化学兴趣小组采用两种方案测定该样品中Na2CO3的质量分数,试回答下列问题。
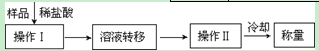
方案一:利用下列方案完成Na2CO3质量分数的測定
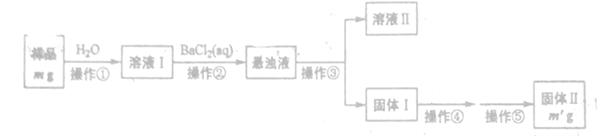
(1)操作③和④的名称分别为_______。
(2)上述操作①~④中,使用到玻璃棒的有______(填操作序号)。
(3)判断操作②否完成的方法是______
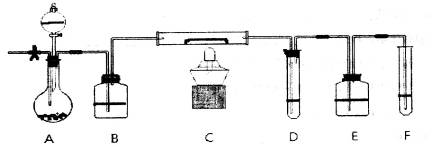
方案二:采用下图实验装置(夹持仪器已省略).选用下列试剂: a.浓硫酸b.饱和NaHCO3溶液C.6mol/L盐酸D.2mol/L硫酸, e.碱石灰f. 无水CaCl2,測定样品中Na2CO3,的质量分数:
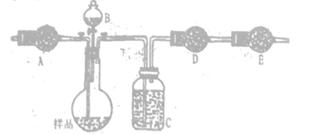
(4)填写表中空格:
方案一:利用下列方案完成Na2CO3质量分数的測定

(1)操作③和④的名称分别为_______。
(2)上述操作①~④中,使用到玻璃棒的有______(填操作序号)。
(3)判断操作②否完成的方法是______
方案二:采用下图实验装置(夹持仪器已省略).选用下列试剂: a.浓硫酸b.饱和NaHCO3溶液C.6mol/L盐酸D.2mol/L硫酸, e.碱石灰f. 无水CaCl2,測定样品中Na2CO3,的质量分数:

(4)填写表中空格:
| 仪器 | 试剂 | 加入该试剂的目的 |
| A | | 鼓入空气时洗去CO2 |
| B | | 使样品充分反应放出气体 |
| C | a | |
| D | e | 充分吸收CO2 |
| E | e | |
(1)过滤、洗涤(2分) (2)①③④(2分) (3)取上层清夜再加入氯化钡溶液,如果不再产生白色沉淀,则说明操作②已经完成,反之没有完成(2分)
(4)(每空2分,共8分。仪器A、B中的试剂填试剂名称也给分)
(4)(每空2分,共8分。仪器A、B中的试剂填试剂名称也给分)
| 仪器 | 试剂 | 加入该试剂的目的 |
| A | e | |
| B | d | |
| C | | 除去CO2中的水蒸气 |
| D | | |
| E | | 防止空气中的CO2、水蒸气被D中的碱石灰吸收 |
试题分析:(1)固体从溶液中分离出的操作是过滤,因此操作③是过滤。过滤后得到的固体需要洗涤和干燥,操作④是洗涤。
(2)溶解、过滤和洗涤均需要玻璃棒,所以操作①~④中,使用到玻璃棒的有①③④。
(3)如果操作②已经完成,则再加入氯化钡溶液会继续产生白色沉淀,所以判断操作②否完成的实验方法是取上层清夜再加入氯化钡溶液,如果不再产生白色沉淀,则说明操作②已经完成,反之没有完成。
(4)碳酸钠能和酸反应生成CO2,所以可以通过测量生成的CO2气体来测定碳酸钠的纯度。为了把装置中的CO2气体全部吸收,需要通过鼓入空气。但由于空气中也含有CO2和水蒸气,所以A装置中盛放的是碱石灰。盐酸易挥发,所以应该用稀硫酸和碳酸钠反应,即B装置中盛放的是稀硫酸。生成的CO2气体中含有水蒸气,所以需要利用能;浓硫酸来吸收CO2中的水蒸气。生成的CO2气体应该用碱石灰吸收,所以D装置中盛放的碱石灰。又因为空气中也含有CO2和水蒸气,所以E装置中也必须盛放碱石灰,以防止空气中的CO2、水蒸气被D中的碱石灰吸收。

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目


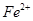 ,如何检验含有Fe2+____________________________________。
,如何检验含有Fe2+____________________________________。