题目内容
【题目】电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质M。下列有关分析或说法中正确的是
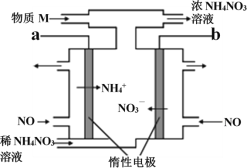
A. a 应接直流电源的正极
B. 补充的物质M是NH3
C. 阳极的电极反应式: NO+5e-+6H+=NH4++H2O
D. 电路中通过5mol 电子时,理论上最多可处理22.4L NO气体(标准状况)
【答案】B
【解析】
电解NO制备NH4NO3,阳极NO失电子发生氧化反应生成硝酸根离子,其电极反应式为:NO - 3e- + 2H2O=NO3-+ 4H+,阴极NO得电子发生还原反应生成铵根离子,其电极反应式: NO + 5e-+ 6H+ = NH4+ + H2O,从两极反应可以看出,若要得失电子数守恒,阳极产生的硝酸根离子大于阴极产生的铵根离子,为保持溶液的电中性,应该及时补充NH3,据此分析作答。
A. a极是NO转化为NH4+的过程,N元素化合价降低,发生还原反应,作电解池的阴极,连接的是直流电源的负极,故A项错误;
B. 结合电子转移数守恒,由上述分析可知,阴极产生的铵根离子小于阳极产生的硝酸根离子,为保持溶液电中性,NH4+与NO3-按物质的量为1:1制备NH4NO3,则应及时补充NH3,故B项正确;
C. 阳极NO失电子发生氧化反应,其电极反应式:NO - 3e- + 2H2O=NO3-+ 4H+,故C项错误;
D. 电解反应总的方程式为:8NO + 7H2O![]() 3NH4NO3+ 2HNO3,根据关系式8NO
3NH4NO3+ 2HNO3,根据关系式8NO![]() 15 e-可知,若通过5 mol电子时,最多处理NO的物质的量为
15 e-可知,若通过5 mol电子时,最多处理NO的物质的量为![]() mol,在标准状况下,NO的体积为
mol,在标准状况下,NO的体积为![]() mol
mol![]() 22.4 L/mol= 59.7 L,故D项错误;
22.4 L/mol= 59.7 L,故D项错误;
答案选B。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:

水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | -72~-74 | 135~138 |
相对密度/(g·cm﹣3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用__________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有________(填标号),不需使用的_______________________(填名称)。

(3)①中需使用冷水,目的是______________________________________。
(4)②中饱和碳酸氢钠的作用是_________________________________,以便过滤除去难溶杂质。
(5)④采用的纯化方法为____________。
(6)本实验的产率是_________%。