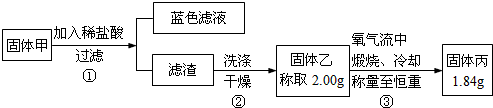
题目内容
10.A、B、C、D都是同一金属元素的化合物,它们的焰色反应呈黄色.A与水反应生成氧气和B;B与二氧化碳反应得到C和水;A与二氧化碳反应生成C和氧气,在C溶液通入二氧化碳,可得到D由此判断A是Na2O2,B是NaOH,C是Na2CO3,D是NaHCO3.
分析 焰色反应呈黄色的物质中一定含有钠元素,过氧化钠与水反应生成氧气和氢氧化钠,氢氧化钠与二氧化碳反应得到碳酸钠和水,过氧化钠和二氧化碳之间反应生成碳酸钠和氧气,在碳酸钠中通入二氧化碳可以得到碳酸氢钠,据此回答.
解答 解:焰色反应呈黄色的物质中一定含有钠元素,过氧化钠与水反应生成氧气和氢氧化钠,氢氧化钠与二氧化碳反应得到碳酸钠和水,过氧化钠和二氧化碳之间反应生成碳酸钠和氧气,在碳酸钠中通入二氧化碳可以得到碳酸氢钠,所以A是Na2O2,B是NaOH,C是Na2CO3,D是NaHCO3,故答案为:Na2O2;NaOH;Na2CO3;NaHCO3.
点评 本题考查学生含有钠元素的化合物的性质等方面的知识,属于基本知识的考查,难度中等.

练习册系列答案
相关题目
1.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氮原子的氮气的体积约为11.2L | |
| B. | 标准状况下,11.2L H2O含有的分子数为0.5NA | |
| C. | 常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| D. | 常温常压下,64g SO2中含有的原子数为3NA |
18.下列关于F、Cl、Br、I的性质的比较,说法错误的是( )
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔点、沸点随核电荷数的增加而增大 | |
| C. | 它们的气态氢化物的热稳定性随核电荷数的增加而减小 | |
| D. | 它们的气态氢化物的还原性随核电荷数的增加而减小 |
5.下列有关说法正确的是( )
| A. | 向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- | |
| B. | Fe与稀硝酸、稀硫酸反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| C. | 在实验室看到的浓硝酸呈黄色是因为浓硝酸中的HNO3易分解 | |
| D. | 在常温下铝与稀硝酸、浓硝酸都能大量产生气体 |
2.设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A. | 常温常压下,18.0g NH4+中所含的质子数为10NA | |
| B. | 室温下,8g甲烷含有共价键数为2NA | |
| C. | 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA | |
| D. | 111g CaCl2晶体中所含共用电子对的数目为2NA |
19.在下列操作中,所使用的仪器能够达到目的是( )
| A. | 用5mL量筒准确量取4.55mL水 | |
| B. | 用托盘天平准确地称取6.82g食盐 | |
| C. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度可以比水大也可以比水小 |