��Ŀ����
����Ŀ����(Sr)Ϊ��������IIA��Ԫ�أ��仯������ˮ�Ȼ���(SrCl26H2O)��ʵ������Ҫ�ķ����Լ�����ҵ�ϳ�������ʯ(��Ҫ�ɷ�ΪSrSO4)Ϊԭ���Ʊ�������������ͼ��
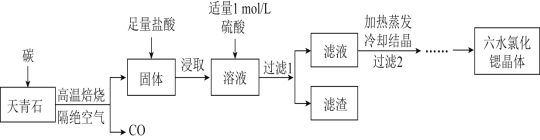
��֪���پ������ȡ�����Һ�г�����Sr2+��Cl-�⣬����������Ba2+���ʡ�
��BaSO4���ܶȻ�����Ϊ1.1��10-10��SrSO4���ܶȻ�����Ϊ3.3��10-7��
��SrCl26H2O��Ħ������Ϊ267g/mol��
��1����ҵ������ʯ����ǰӦ����ĥ���飬��Ŀ����__��
��2����ҵ������ʯ�����������±���ʱ����0.5molSrSO4��ֻ��SԪ�ر���ԭ����ת����4mol���ӡ���÷�Ӧ�Ļ�ѧ����ʽΪ__��
��3����ȡ����������Ŀ���� �����ӷ���ʽ��ʾ __��Ϊ�����ԭ�ϵ������ʣ���Һ��Sr2+��Ũ��Ӧ������__mol/L��
��ע����ʱ��Һ��Ba2+Ũ��Ϊ1.0��10-5mol/L����
��4����Ʒ���ȼ�⣺��ȡ1.000g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO30.01mol��AgNO3��Һ����Һ�г�Cl-�⣬����������Ag+��Ӧ������ ����Cl-��ȫ��������1��2�κ�Fe3+����Һ��ָʾ������0.2000mol/L��NH4SCN����Һ�ζ�ʣ���AgNO3��ʹʣ���Ag+��AgSCN��ɫ��������ʽ��������֪��SCN-����Ag+��Ӧ��
�ٵζ���Ӧ�ﵽ�յ��������__��
�����ζ�������ȥ����Ũ�ȵ�NH4SCN��Һ20.00mL�����Ʒ��SrCl26H2O�������ٷֺ���Ϊ___(����3λ��Ч����)��
��5����SrCl26H2O������ȡ��ˮ�Ȼ��ȵ���Ҫ�������˾ƾ��ơ������ǡ����ż��⣬����___��
���𰸡����ӷ�Ӧ��ĽӴ���������ѧ��Ӧ���� SrSO4+4C![]() SrS+4CO�� SO42-+Ba2+=BaSO4�� 0.03 ���������1��NH4SCN��Һʱ����Һ����ɫ��Ϊ��ɫ����30s�ڲ���ɫ 80.1% ����
SrS+4CO�� SO42-+Ba2+=BaSO4�� 0.03 ���������1��NH4SCN��Һʱ����Һ����ɫ��Ϊ��ɫ����30s�ڲ���ɫ 80.1% ����
��������
������ʯ(��Ҫ�ɷ�ΪSrSO4)Ϊԭ���Ʊ���ˮ�Ȼ���(SrCl26H2O)�������̿�֪������ʯ��̼�����������±�������CO��SrS��SrS���������Һ�г�����Sr2+��Cl-�⣬����������Ba2+���ʣ�Ȼ��������������ᱵ���������Թ��˺�����Ϊ���ᱵ����Һ�к�SrSO4��SrCl2�������������ȴ�ᾧ�õ�SrCl26H2O���ݴ˷������
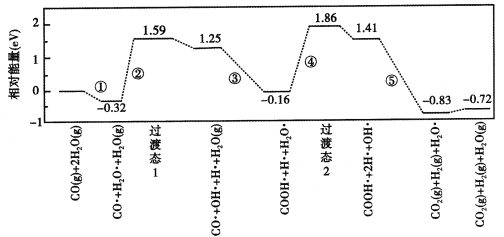
(1)��ĥ�����Ŀ�������ӷ�Ӧ��ĽӴ���������ѧ��Ӧ���ʣ�
(2)��SrSO4��ֻ��S����ԭ����1mol SrSO4��Ӧ����ת��8mol����÷�Ӧ�Ļ�ѧ����ʽΪSrSO4+4C ![]() SrS+4CO����
SrS+4CO����
(3)����HCl�ܽ�SrS�����Һ�м��������Ŀ���dz�ȥ��Һ��Ba2+���ʣ���ӦΪ��SO42-+Ba2+=BaSO4����������Ba2+Ũ��Ϊ1��10-5 mol/L��BaSO4���ܶȻ�����Ϊ1.1��10-10������c(SO42-)=![]() mol/L=1.1��10-5mol/L����SrSO4���ܶȻ�����Ϊ3.3��10-7������c(Sr2+)=
mol/L=1.1��10-5mol/L����SrSO4���ܶȻ�����Ϊ3.3��10-7������c(Sr2+)=![]() mol/L=3.0��10-2=0.03mol/L��
mol/L=3.0��10-2=0.03mol/L��
(4)����NH4SCN����ʣ���Ag+����γ�AgSCN��ɫ��������Һ�оͻẬ��SCN-���ͻ���Fe3+�������������Һ��Ϊ��ɫ����˵ζ��ﵽ�յ�ʱ��Һ����ɫ��ΪѪ��ɫ����30 s����ɫ��
��n(NH4SCN)=0.2000mol/L��0.02L=4.0��10-3mol��Ag+��AgSCN��ɫ��������ʽ������������Һ��ʣ���Ag+�����ʵ���Ϊ��n(Ag+)=4.0��10-3mol������Cl-��Ӧ��Ag+�����ʵ���Ϊ��n(Ag+)=1��10-2 mol-4.0��10-3mol=6.0��10-3mol��1.000g��Ʒ��SrCl26H2O�����ʵ���Ϊ��n(SrCl26H2O)=![]() ��n(Ag+)=3��10-3mol��1.000g��Ʒ��SrCl26H2O������Ϊ��m(SrCl26H2O)=3��10-3mol��267 g/mol=0.801g�����Բ�Ʒ����Ϊ��
��n(Ag+)=3��10-3mol��1.000g��Ʒ��SrCl26H2O������Ϊ��m(SrCl26H2O)=3��10-3mol��267 g/mol=0.801g�����Բ�Ʒ����Ϊ��![]() ��100%=80.1%��
��100%=80.1%��
(5)��SrCl26H2O������ȡ��ˮ�Ȼ��ȵ������оƾ��ơ������ǡ����żܡ�������