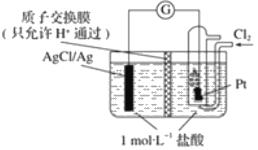
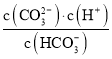��Ŀ����
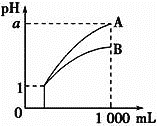
����Ŀ�������£��������Ϊ1 mL��Ũ�Ⱦ�Ϊ0.10 mol/L��XOH��X2CO3��Һ�ֱ��ˮϡ�������ΪV mL��pH��lg V�ı仯�����ͼ��ʾ��������������ȷ����

A. XOH������
B. pH=10��������Һ�е�c(X+):XOH>X2CO3
C. ��֪H2CO3�ĵ���ƽ�ⳣ��Ka1Զ����Ka2����Ka2ԼΪ1.0��1010.2
D. ��lg V=2ʱ����X2CO3��Һ���¶����ߣ���Һ������ǿ���� ��С
��С
���𰸡�C
��������
A������ͼ֪��0.1mol/L��XOH��pH=13��˵��XOH��Һ��c��OH-��=c��XOH����
B��XOH��ǿ����Һ��X2CO3��ǿ����������Һ��Ҫʹ������Һ��pH��ȣ���c��XOH����c��X2CO3�����ٽ�������غ��жϣ�
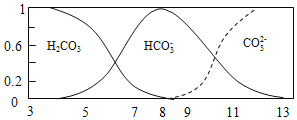
C.0.10mol/LX2CO3��Һ��pH=11.6�������Һ��c��OH-��=c��HCO3-��=![]() mol/L=10-2.4 mol/L��c��CO32-��=0.1mol/L��Kh1=
mol/L=10-2.4 mol/L��c��CO32-��=0.1mol/L��Kh1=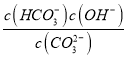 =
=![]() ����Ka2=
����Ka2=![]() =
=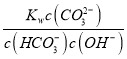 ��
��
D����lgV=2ʱ������Һ�������Ϊԭ����100���������¶ȣ��ٽ�ˮ�⣬��һ��ˮ��̶�ԶԶ���ڵڶ�����������Һ��c��CO32-����С��c��HCO3-������
A������ͼ֪��0.1mol/L��XOH��pH=13��˵��XOH��Һ��c��OH-��=c��XOH����XOH��ȫ���룬Ϊǿ����ʣ�ѡ��A����
B��XOH��ǿ����Һ��X2CO3��ǿ����������Һ��Ҫʹ������Һ��pH��ȣ���c��XOH����c��X2CO3�����ٽ�������غ��c��X+����XOHС��X2CO3��ѡ��B����
C.0.10mol/LX2CO3��Һ��pH=11.6�������Һ��c��OH-��=c��HCO3-��=![]() mol/L=10-2.4 mol/L��c��CO32-��=0.1mol/L��Kh1==
mol/L=10-2.4 mol/L��c��CO32-��=0.1mol/L��Kh1==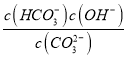 =
=![]() ����Ka2=
����Ka2=![]() =
=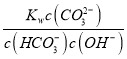 =
=![]() =1.0��10-10.2��ѡ��C��ȷ��
=1.0��10-10.2��ѡ��C��ȷ��
D����lgV=2ʱ������Һ�������Ϊԭ����100���������¶ȣ��ٽ�ˮ�⣬��һ��ˮ��̶�ԶԶ���ڵڶ�����������Һ��c��CO32-����С��c��HCO3-����������![]() ����ѡ��D����
����ѡ��D����
��ѡC��

 �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д� �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�����Ŀ����������ʵ������������ܵó���Ӧ���۵���(����)
ѡ�� | ʵ����� | ���� | ���� |
A | SO2����ͨ����з�̪��NaOH��Һ�� | ��Һ��ɫ��ȥ | SO2����Ư���� |
B | ������NO2���ܱղ������������ˮ�� | �������ɫ���� | 2NO2(g) |
C | ij��ɫ��ҺX�м�����ۣ�KI��Һ | ��Һ�����ɫ | ��ҺX�к���Br2 |
D | ��ˮ�Ҵ��м���Ũ���ᣬ���ȣ�����������Yͨ������KMnO4��Һ | ��Һ��ɫ��ȥ | ����Y�к�����ϩ |
A. AB. BC. CD. D
����Ŀ��ij��ҵ��ˮ����Ҫ����Cr3����ͬʱ������������Fe3����Fe2����Al3����Ca2����Mg2���ȣ������Խ�ǿ��Ϊ�������ã�ͨ�������������̴�����
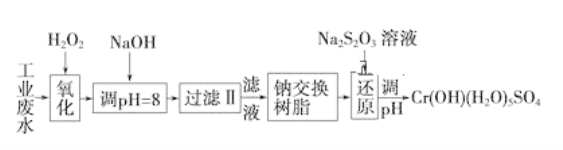
ע�����������ӳ�����������������ʽ��ȫ����ʱ��Һ��pH���±���
�������� | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9�ܽ�) |
��1�����������пɴ���H2O2������Լ���________(�����)��
A��Na2O2 B��HNO3 C��FeCl3 D��KMnO4
��2������NaOH��Һ������ҺpH��8ʱ����ȥ��������________����֪�����ӽ�����֬��ԭ����Mn����nNaR��MRn��nNa�����˲�������������ȥ������������__________��
A��Fe3��B��Al3��C��Ca2��D��Mg2��
��3����ԭ�����У�ÿ����0.8 mol Cr2O72-ת��4.8 mol e�����÷�Ӧ���ӷ���ʽΪ____________��