题目内容
【题目】某原电池装置如图所示,电池总反应为 2Ag+Cl2═2AgCl。
(1)写出该电池工作时的两极反应:负极:___;正极:___。
(2)当电路中转移amole﹣时,交换膜左侧溶液中约减少___mol离子;交换膜右侧溶液c(HCl)___(填“>”“<”或“=”)1molL-1(忽略溶液体积变化)。

【答案】2Ag﹣2e﹣+2Cl﹣=2AgCl Cl2+2e﹣=2Cl﹣ 2a >
【解析】
(1)原电池中正极得电子发生还原反应;负极失电子发生氧化反应;
(2)原电池电路中电子守恒,据此计算。
(1)原电池总反应为2Ag+Cl2=2AgCl,则反应中银化合价升高、发生氧化反应,氯气中的氯元素化合价降低、发生还原反应,所以银作原电池负极,Pt作原电池的正极,装置左侧即负极电极反应式为Ag﹣e﹣+Cl﹣=AgCl,正极电极反应式为Cl2+2e﹣=2Cl﹣,结合电子守恒写出电极反应式:负极电极反应式为2Ag﹣2e﹣+2Cl﹣=2AgCl,正极电极反应式为Cl2+2e﹣=2Cl﹣,故答案为:2Ag﹣2e﹣+2Cl﹣=2AgCl;Cl2+2e﹣=2Cl﹣;
(2)负极电极反应式为Ag﹣e﹣+Cl﹣=AgCl,原电池工作时,电路中转移amole﹣,则负极消耗amolCl﹣,形成闭合回路移向正极的n(H+)=amol,所以负极区即交换膜左侧溶液中约减少2amol离子;正极区电极反应为Cl2+2e﹣=2Cl﹣,生成n(HCl)=amol,所以交换膜右侧溶液c(HCl)增大,即交换膜右侧溶液 c(HCl)>1mol/L,故答案为:2a;>。

【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
【题目】根据下表中的信息判断,下列说法错误的是
序号 | 反应物 | 产物 |
① | Cl2、H2O2 | Cl-、…… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | KClO3、HCl | Cl2、KCl、H2O |
A.第①组反应的氧化产物为O2
B.第②组反应中C12与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成3mol C12,转移6mol电子
D.氧化性由强到弱的顺序为C1O3- >C12>Fe3+
【题目】已知NO2和N2O4可以相互转化:反应2NO2(g)![]() N2O4(g)△H=﹣57.2kJ/mol。
N2O4(g)△H=﹣57.2kJ/mol。
(1)一定温度下,现将1molN2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是___(填序号,下同)。
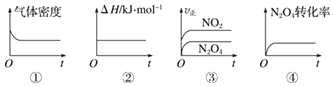
(2)若反应2NO2(g)N2O4(g)在体积为1L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量N2O4,平衡向___移动(填“左”、“右”或“不”),重新平衡后和原平衡相比,混合气体颜色___(填“变深”“变浅”或“不变”),N2O4 的体积分数___(填“增大”、“减小”或“不变”)。
(3)一定温度下,向容积为20L的密闭容器中充入1molNO2气体,发生反应2NO2(g)N2O4(g),反应中测得相关数据如表所示:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
气体相对分子质量 | 46 | 57 | 64 | 69 | 69 | 69 |
①此条件下该反应的化学平衡常数K=___。
②在50min末,向容器中加入![]() molNO2,若要保持平衡不发生移动,应加入N2O4为___mol。
molNO2,若要保持平衡不发生移动,应加入N2O4为___mol。