题目内容
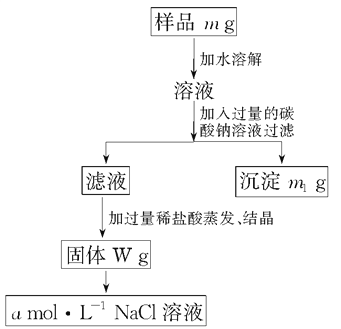
【题目】欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol·L-1的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
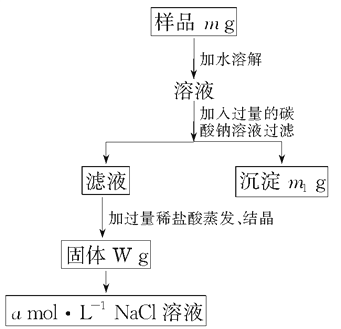
(1)称量粗盐样品m g,所用仪器名称为:_____________。
(2)过滤时,玻璃棒的作用是:__________________。
(3)蒸发操作时应将液体放在__________中加热,等加热至________时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是__________________,反应的化学方程式是______________________________________。
(5)在滤液中加入盐酸的作用是____________________________________,
反应的离子程式是_______________________________________。
(6)配制100 mL 1 mol·L-1的NaCl溶液时,应从W g固体中称取NaCl的质量为________,配制时应在________中进行定容。
【答案】 托盘天平 引流 蒸发皿 出现大量晶体 使钙离子完全形成沉淀而除去 CaCl2+Na2CO3===CaCO3↓+2NaCl 除去过量的Na2CO3 CO32-+2H+===H2O+CO2↑ 5.9 g 100 mL容量瓶
【解析】(1)称量固体的仪器为:托盘天平。
(2)过滤时要使用玻璃棒:引流。
(3)蒸发操作时应将液体放在蒸发皿中加热,等出现大量晶体时即停止加热,利用余热使水分蒸干。故答案为:蒸发皿;出现大量晶体。
(4)NaCl固体中含有少量CaCl2,溶解后,加入过量的Na2CO3溶液,使钙离子完全形成沉淀而除去,反应方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl。
(5)过滤,滤液中主要成分为NaCl和少量未反应完的Na2CO3,加入稀盐酸除去过量的Na2CO3,反应的离子方程式为:CO32-+2H+=H2O+CO2↑。
(6)配制100 mL 1 mol/L的NaCl溶液,需NaCl的质量m=cVM=1 mol/L×0.1L×58.5g/mol=5.85g。由于托盘天平的精确度为0.1g,故称量5.9g。配制100mL一定物质的量浓度的溶液应在100mL容量瓶中定容。故答案为:5.9g;100mL容量瓶。