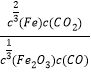题目内容
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
⑴工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法 已知:H2S(g) ![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
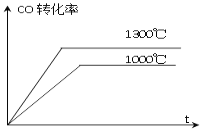
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图1。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:

i S2的结构式为______,该反应的△H_____0(填“>”、“<”或“=”);
ii 计算 985 ℃时H2S按上述反应分解的平衡常数K=________;
iii 比较H2S的速率大小:v(a-逆)______v(b-正) ,v(b-逆)______v(c-正) (填“>”、“<”或“=”);
iiii 说明随温度的升高,曲线b向曲线a逼近的原因:___________;
②电化学法

i该法制氢过程如图2。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为___________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为__________________________。
【答案】![]() b、eS=S>
b、eS=S>![]() <<温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理答案)增大反应物接触面积,使反应更充分H2S+2FeCl3===2FeCl2+S↓+2HCl2Fe2++2H+
<<温度升高,反应速率加快,达到平衡所需的时间缩短(或其他合理答案)增大反应物接触面积,使反应更充分H2S+2FeCl3===2FeCl2+S↓+2HCl2Fe2++2H+![]() 2Fe3++H2↑
2Fe3++H2↑
【解析】
(1)①M为+3价,R为+4价,均为第三周期元素,则M为Al,R为Si,Si的质子数为14,其原子结构示意图为 ,故答案为:
,故答案为: ;②M为Al具有还原性,能与具有氧化性的物质发生反应,如a、c,还能与d中NaOH溶液反应生成氢气,而高温下与氧化铁反应,与碳酸钠不反应,故答案为:b、e;
;②M为Al具有还原性,能与具有氧化性的物质发生反应,如a、c,还能与d中NaOH溶液反应生成氢气,而高温下与氧化铁反应,与碳酸钠不反应,故答案为:b、e;
(2)i.S2的结构式为S=S,由a曲线的变化趋势可得随温度的升高,H2S的平衡转化率增大,说明升温,平衡正向移动,正反应为吸热反应,该反应的△H>0;
ii.以H2S起始浓度均为cmol·L-1测定H2S的转化率,985℃时H2S的转化率为40%,则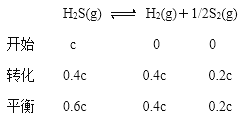
K=![]() =
= ![]() ,故答案为:
,故答案为:![]() ;
;
iii.曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率,由平衡状态的建立过程可知v(b-正)逐渐减小,达平衡后与v(a-逆)相等,v(b-逆)逐渐增大,最终与v(c-正)相等,故答案为:<、<;
iiii. 温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,曲线b向曲线a逼近,故答案为:温度升高,反应速率加快,达到平衡所需的时间缩短;
②i.反应池中反应物的流向采用气、液逆流方式,可增大反应物接触面积;ii. 反应池中发生氧化还原反应为H2S+2FeCl3=2FeCl2+S↓+2HCl;iii.电解池中亚铁离子失去电子,氢离子得到电子,电解总反应的离子方程式为2Fe2++2H+![]() 2Fe3++H2↑;故答案为:增大反应物接触面积,使反应更充分;H2S+2FeCl3=2FeCl2+S↓+2HCl;2Fe2++2H+
2Fe3++H2↑;故答案为:增大反应物接触面积,使反应更充分;H2S+2FeCl3=2FeCl2+S↓+2HCl;2Fe2++2H+![]() 2Fe3++H2↑。
2Fe3++H2↑。

 快捷英语周周练系列答案
快捷英语周周练系列答案