题目内容
【题目】设NA表示阿伏加德罗常数的值,下列判断正确的是( )
①. 标准状况下,22.4LSO3中含有的原子数目为4NA
② 在常温常压下,48g 氧气和臭氧的混合气体含氧原子数是3NA
③1molCl2参加反应转移电子数一定为2NA
④ lmolNa2O2 与水充分反应转移的电子数为2NA
⑤ 0.1mol/L BaCl2溶液中Cl-数目是0.2 NA
⑥ 4℃时,22.4 L水中含有的电子数目为 10 NA个
⑦ 使2.3g钠变为 Na+,需失去0.1NA个电子
⑧ 10g46%乙醇水溶液中所含氢原子数目为0.6NA
A. ①②③⑧ B. ②③⑦⑧ C. ②⑦ D. 全部
【答案】C
【解析】
①标准状况下三氧化硫不是气体,22.4LSO3中含有的原子数目不是4NA,①错误;
②氧气和臭氧均是氧元素形成的不同单质,在常温常压下,48g氧气和臭氧的混合气体中氧原子的物质的量是48g÷16g/mol=3mol,含氧原子数是3NA,②正确;
③1molCl2参加反应转移电子数不一定为2NA,例如与氢氧化钠溶液反应时转移1mol电子,③错误;
④lmolNa2O2与水时过氧化钠既是氧化剂,也是还原剂,则充分反应转移的电子数为NA,④错误;
⑤0.1mol/L BaCl2溶液的体积未知,不能计算其中Cl-数目,⑤错误;
⑥4℃时,22.4 L水的物质的量不是1mol,含有的电子数目不是10NA个,⑥错误;
⑦使2.3g钠即0.1mol钠变为Na+,需失去0.1NA个电子,⑦正确;
⑧10g46%乙醇水溶液中所含氢原子的物质的量是![]() =1.2mol,因此氢原子数目为1.2NA,⑧错误;
=1.2mol,因此氢原子数目为1.2NA,⑧错误;
答案选C。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
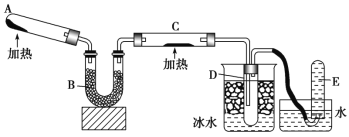
阳光同学一线名师全优好卷系列答案【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D