题目内容
【题目】物质结构与性质]单质铁、锂、砷及它们的化合物广泛应用于超导体材料等领域,回答下列问题:
(1)Fe原子的核外电子排布式为[Ar]_________,Li原子核外占据最高能层电子的电子云轮廓图形状为_________。
(2)As 的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是_________,AsCl3分子的立体构型为_________。
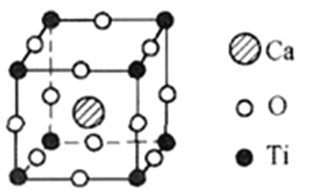
(3)铁、锂、砷形成的化合物LiFeAs是一种超导体,其晶胞结构如图1所示,已知立方晶胞参数acm,则该晶休的密度是_________g/cm3(用含a、NA的式子表示)。


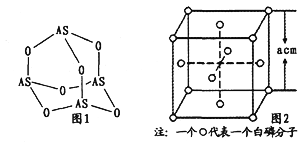
(4)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图2所示,图中M代表Fe3+。则1号碳原子有_______个σ键,2号碳原子采取_________杂化方式;Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________;该配合物中,第二周期的三种元素的第一电离能由大到小的顺序为_________。
【答案】 3d64s2 球形 对于组成和结构相似物质,相对分子质量逐渐增大,分子间作用力逐渐增强,熔点逐渐升高 三角锥形 ![]() 4 sp2 配位键 6 N>O>C
4 sp2 配位键 6 N>O>C
【解析】(1)本题考查电子排布式书写、电子云形状,Fe属于26号元素,因此核外电子排布式为[Ar]3d64s2;Li的电子排布式为1s22s1,最高能层电子的能级为s,电子云的轮廓图为球形;(2)本题考查物质熔沸点高低判断、立体构型,AsCl3、AsBr3、AsI3组成和结构相似,相对分子质量大小顺序是AsI3>AsBr3>AsCl3,相对分子质量越大,范德华力越大,熔沸点越高;AsCl3中心原子As,有3个σ键,孤电子对数为(5-3×1)/2=1,价层电子对数为4,因此AsCl3的立体构型为三角锥形;(3)本题考查晶胞的计算,根据晶胞结构,Fe位于晶胞的顶点、棱上和面心,个数为8×1/8+2×1/2+8×1/4=4,As位于晶胞内部,个数有4个,Li位于晶胞内部,有4个,因此晶胞的质量为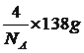 ,晶胞的体积为a3cm3,根据密度的定义,因此该晶胞的密度为
,晶胞的体积为a3cm3,根据密度的定义,因此该晶胞的密度为![]() g/cm3;(4)本题考查共价键、杂化类型判断、配位键、电离能规律,根据图2,1号碳原子含有4个σ键,2号碳原子有3个σ键,无孤电子对,价层电子对数为3,即杂化类型为sp2;一个N原子形成三个共价键,达到“饱和”,现在N有4个键,因此Fe3+和N之间形成的化学键为配位键;根据图2,Fe3+配位数为6;同周期从左向右第一电离能逐渐增大,但IIA>IIIA、VA>VIA,因此第一电离能的大小是N>O>C。
g/cm3;(4)本题考查共价键、杂化类型判断、配位键、电离能规律,根据图2,1号碳原子含有4个σ键,2号碳原子有3个σ键,无孤电子对,价层电子对数为3,即杂化类型为sp2;一个N原子形成三个共价键,达到“饱和”,现在N有4个键,因此Fe3+和N之间形成的化学键为配位键;根据图2,Fe3+配位数为6;同周期从左向右第一电离能逐渐增大,但IIA>IIIA、VA>VIA,因此第一电离能的大小是N>O>C。