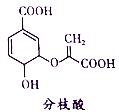
题目内容
【题目】(1)原电池反应通常是放热反应,下列反应中在理论上可设计成原电池的反应为____________(填字母),
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) ΔH>0
C.CaC2(s)+2H2O(l)===Ca(OH)2(s)+C2H2(g) ΔH<0
D.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH<0
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计原电池,其负极反应_________________。
(3)电解原理在化学工业中有着广泛的应用,现将设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y为两块电极板,则:
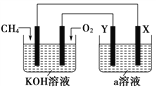
①若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是____________________________________。
②若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象是____________________________________________。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol CuO,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为________。
【答案】 D CH4+10OH--8e-=CO32-+7H2O 将湿润的淀粉碘化钾试纸靠近Y极上方,若试纸变蓝,说明有氯气生成 白色固体迅速变为灰绿色,最后变成红褐色 0.2 mol
【解析】(1)能构成原电池的条件之一是:该反应是放热反应,即△H<O,且该反应必须是能自发进行的氧化还原反应。A、该反应是吸热反应,选项A错误;B、该反应是吸热反应且是非氧化还原反应,选项B错误;C、该反应是放热反应但是非氧化还原反应,选项C错误;D、该反应是放热反应且是能自发进行的氧化还原反应,选项D正确。答案选D;(2)以KOH溶液为电解质溶液,负极甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4+10OH--8e-=CO32-+7H2O;(3)①当石墨作电极时,阳极Y上氯离子失电子生成氯气,氯气有氧化性能和碘离子发生置换反应生成碘单质,淀粉遇碘变蓝色,所以检验氯气的方法是将湿润的淀粉KI试纸靠近Y极支管口处,试纸变蓝,说明有氯气生成;②阳极为铁电极时,阳极反应为Fe-2e-=Fe2+,所以有Fe(OH)2生成,露置在空气中时迅速变为灰绿色,最终变为红褐色;③根据“电解出什么物质加入什么物质”的方法知,加入0.1 mol CuO,所以发生电解时生成氧气和铜,根据原子守恒知:0.1mol的CuO,则相当于生成0.05mol氧气;转移的电子的物质的量为0.05mol×4 =0.2mol。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】物质结构与性质]单质铁、锂、砷及它们的化合物广泛应用于超导体材料等领域,回答下列问题:
(1)Fe原子的核外电子排布式为[Ar]_________,Li原子核外占据最高能层电子的电子云轮廓图形状为_________。
(2)As 的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是_________,AsCl3分子的立体构型为_________。
(3)铁、锂、砷形成的化合物LiFeAs是一种超导体,其晶胞结构如图1所示,已知立方晶胞参数acm,则该晶休的密度是_________g/cm3(用含a、NA的式子表示)。


(4)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图2所示,图中M代表Fe3+。则1号碳原子有_______个σ键,2号碳原子采取_________杂化方式;Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________;该配合物中,第二周期的三种元素的第一电离能由大到小的顺序为_________。