题目内容
【题目】【化学-选修3:物质结构与性质】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为_______;As原子的核外电子排布式为______________。
(2)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
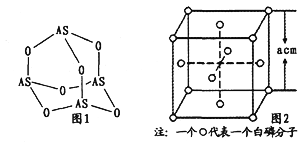
(3)Na3AsO4中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是_________。
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为___g·cm-3(用含NA、a的式子表示)。
【答案】 N>P>As 1s22s22p63s23p63d104s24p3 高 NH3分子间存在较强的氢键作用,而PH3分子间仅有较弱的范德华力 离子键、共价键 正四面体 sp3 16 ![]()
【解析】试题分析:(1)同主族元素从上到下第一电离能减小;根据能量最低原则书写As原子的核外电子排布式;(2) NH3分子间存在较强的氢键;(3)Na3AsO4是离子化合物,含有离子键,AsO43-中As与O之间是共价键;AsO43-的价电子对数是![]() ,无孤对电子;As4O6的分子中As通过3个
,无孤对电子;As4O6的分子中As通过3个![]() 键与O原则结合,所以As原子价电子对数是
键与O原则结合,所以As原子价电子对数是![]() ;(4)根据均摊原则计算P原子数;根据
;(4)根据均摊原则计算P原子数;根据![]() 计算晶胞的密度;
计算晶胞的密度;
解析:(1)同主族元素从上到下第一电离能减小,所以N、P、As原子的第一电离能由大到小的顺序为N>P>As;根据能量最低原则,As原子的核外电子排布式为1s22s22p63s23p63d104s24p3;(2) NH3分子间存在较强的氢键作用,而PH3分子间仅有较弱的范德华力,NH3的沸点比PH3高; (3)Na3AsO4是离子化合物,含有离子键,AsO43-中As与O之间是共价键,Na3AsO4中含有的化学键类型包括离子键、共价键;AsO43-的价电子对数是![]() ,无孤对电子,所以AsO43-的空间构型为正四面体;As4O6的分子中As通过3个
,无孤对电子,所以AsO43-的空间构型为正四面体;As4O6的分子中As通过3个![]() 键与O原则结合,所以As原子价电子对数是
键与O原则结合,所以As原子价电子对数是![]() ,所以As的杂化方式是sp3;(4)根据均摊原则,P原子数=
,所以As的杂化方式是sp3;(4)根据均摊原则,P原子数=![]() ;晶胞的摩尔质量是
;晶胞的摩尔质量是![]() ,1个晶胞的体积是
,1个晶胞的体积是![]() ,
, ![]() =
=![]() g·cm-3。
g·cm-3。

【题目】物质结构与性质]单质铁、锂、砷及它们的化合物广泛应用于超导体材料等领域,回答下列问题:
(1)Fe原子的核外电子排布式为[Ar]_________,Li原子核外占据最高能层电子的电子云轮廓图形状为_________。
(2)As 的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是_________,AsCl3分子的立体构型为_________。
(3)铁、锂、砷形成的化合物LiFeAs是一种超导体,其晶胞结构如图1所示,已知立方晶胞参数acm,则该晶休的密度是_________g/cm3(用含a、NA的式子表示)。


(4)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图2所示,图中M代表Fe3+。则1号碳原子有_______个σ键,2号碳原子采取_________杂化方式;Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________;该配合物中,第二周期的三种元素的第一电离能由大到小的顺序为_________。