题目内容
【题目】按如图所示的装置进行实验:A极是铜锌合金,B极是纯铜,电解质溶液中含有足量的铜离子,通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68 g,溶液质量增加0.03 g,则A合金中Cu、Zn的物质的量之比为
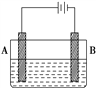
A. 4∶1 B. 3∶1 C. 2∶1 D. 1∶1
【答案】B
【解析】B极上析出的是铜,B极质量增加7.68g,其物质的量=![]() =0.12mol;阳极上溶解锌时,阴极上析出铜,所以溶液质量增加的质量为锌和铜的质量差,溶液质量增加0.03g,即锌和铜的质量差为0.03g。设锌的物质的量为x,则:
=0.12mol;阳极上溶解锌时,阴极上析出铜,所以溶液质量增加的质量为锌和铜的质量差,溶液质量增加0.03g,即锌和铜的质量差为0.03g。设锌的物质的量为x,则:
Zn+Cu2+═Zn2++Cu 质量增加
1mol 1g
x 0.03g
x=0.03mol,即合金中锌的物质的量是0.03mol,根据氧化还原反应中得失电子数相等知,阳极上锌和铜失去的电子数等于阴极上铜离子得到的电子,设合金中铜的物质的量为y,则:0.03mol×2+2y=0.12mol×2,解得y=0.09mol,所以合金中铜和锌的物质的量之比为0.09mol:0.03mol=3:1,所以铜和锌的原子个数之比是3:1,答案选B。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】物质结构与性质]单质铁、锂、砷及它们的化合物广泛应用于超导体材料等领域,回答下列问题:
(1)Fe原子的核外电子排布式为[Ar]_________,Li原子核外占据最高能层电子的电子云轮廓图形状为_________。
(2)As 的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是_________,AsCl3分子的立体构型为_________。
(3)铁、锂、砷形成的化合物LiFeAs是一种超导体,其晶胞结构如图1所示,已知立方晶胞参数acm,则该晶休的密度是_________g/cm3(用含a、NA的式子表示)。


(4)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图2所示,图中M代表Fe3+。则1号碳原子有_______个σ键,2号碳原子采取_________杂化方式;Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________;该配合物中,第二周期的三种元素的第一电离能由大到小的顺序为_________。