题目内容
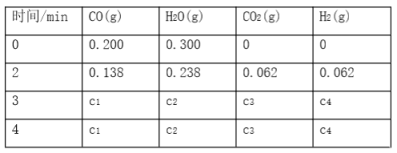
【题目】工业上制备H2的一种重要方法是:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850 ℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
CO2(g)+H2(g) ΔH=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850 ℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
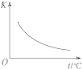
已知:850 ℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是________。
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q______0(填“>”“=”或“<”)。
(3)若在850 ℃时向反应容器中充入H2O(g),K值________________(填“增大”“减小”或“不变”)。
(4)上表中c2为________________,CO(g)的转化率为________________________。
【答案】C < 不变 0.18 60%
【解析】
(1)根据平衡状态的含义和特征分析解答;
(2)根据温度对平衡常数的影响判断△H;
(3)根据影响平衡常数的因素分析解答;
(4)结合平衡常数根据三段式计算。
(1)A.任何时候,单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度,不能说明到达平衡,故A错误;
B.反应前后气体的物质的量不变,温度一定,容器中压强始终不变,所以压强不发生变化,不能说明到达平衡,故B错误;
C.反应达到平衡状态时,各物质的浓度不变,说明到达平衡状态,故C正确;
D.任何时候,氢气的生成速率等于水的消耗速率,不能说明到达平衡状态,故D错误;
故答案选:C.
(2)由图可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故△H<0;
(3)在850℃时向反应容器中充入H2O(g),平衡正向移动,但温度不变,所以平衡常数K值不变;
(4) CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始(mol/L) 0.200 0.300 0 0
反应(mol/L) a a a a
平衡(mol/L) 0.200-a 0.300-a a a
则![]()
解得a=0.12
所以c2=0.300mol/L-0.12mol/L=0.18mol/L,CO(g)的转化率为0.12/0.200×100%=60%。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】含氮化合物与生产、生活、生命和环境息息相关。
(1)NO加速臭氧层被破坏,其反应过程如图所示。
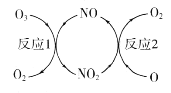
①NO的作用是________________________。
②已知:O3(g)+O(g) =2O2(g) △H=-143kJ·mol-1
反应l:O3(g)+NO(g) =NO2(g)+O2(g)△H1=-200.2kJ·mol-1
则反应2的热化学方程式为____________________________。
(2)肌红蛋白(Mb)是肌肉内储存氧的蛋白质,构成肌红蛋白的甘氨酸(H2NCH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下 三种离子的物质的量分数(δ)与[
三种离子的物质的量分数(δ)与[![]() ]的关系如图所示。
]的关系如图所示。
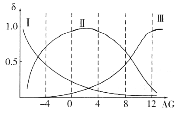
①溶液呈中性时,三种离子浓度由大到小的顺序为______________________。
②向AG=12的溶液中加入过量NaOH溶液时,主要反应的离子方程式为______________。
(3)肌红蛋白(Mb)可与O2结合生成MbO2:![]() 。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的物质的量分数]
p(O2)/kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
①计算37℃时,上述反应的平衡常数K=__________kPa-1(气体和溶液中的溶质分别用分压和物质的量浓度表示)。
②37℃时,若空气中氧气分压为21.0 kPa,则人正常呼吸时α的最大值为________%(保留1位小数)。
③温度不变时,游客在山顶时体内MbO2的浓度比在山下________(填“高”或“低”)。
④研究发现,v正=k正·c(Mb)·p(O




