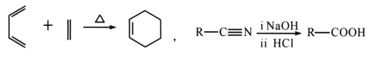
题目内容
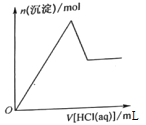
【题目】如图是恒温下某气体参加的化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是
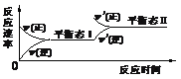
A. 反应达平衡时,正反应速率和逆反应速率相等
B. 该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
C. 该反应达到平衡态I后,增大反应物的压强,平衡发生移动,达到平衡态II
D. 在平衡态I和平衡态II时,同一种反应物浓度不相等
【答案】C
【解析】
由图可知,该反应从正反应一端开始,正逆反应速率相等时为平衡状态Ⅰ,然后改变条件,正反应速率大于逆反应速率,该反应向正反应方向移动,且改变条件的一瞬间逆反应速率不变,以此来解答。
A.由平衡的特征可知,反应达平衡时,正反应速率和逆反应速率相等,故A正确;
B、该反应达到平衡态Ⅰ后,增大反应物浓度,一瞬间正反应速率增大,逆反应速率不变,平衡正向移动,达到平衡态Ⅱ,故B正确;
C、增大反应物的压强,正逆反应速率在瞬间都增大,故C错误;
D、该反应达到平衡态Ⅰ后,改变条件使反应继续正向移动达到平衡态Ⅱ,所以同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等,故D正确。

练习册系列答案
相关题目