题目内容
【题目】如图为 A、B 元素的原子结构示意图。下列说法错误的是( )

A.B 的原子结构示意图中 x 为 12
B.A 和 B 分别属于非金属元素和金属元素
C.A 的原子和 B 的原子分别形成简单离子的过程相同
D.A 与 B 可组成化学式为 BA2 的化合物
【答案】C
【解析】
A.原子中质子数等于电子数,所以B的原子核外有12个电子,则质子数是12,即x=12,故A正确;
B.A的最外层电子数是7,大于4属于非金属元素,B的最外层电子数是2,小于4,属于金属元素,故B正确;
C.A的最外层电子数是7,化学反应中易得电子,B的最外层电子数是2,化学反应中易失电子,所以A的原子和B的原子分别形成简单离子的过程不相同,故C错误;
D.A的最外层电子数是7,化学反应中易得到1个电子,而带一个单位的负电荷,化合价为﹣1价,B的最外层电子数是2,化学反应中易失掉2个电子,而带两个单位的正电荷,化合价为+2价,所以A与B可组成化学式为BA2的化合物,故D正确;
故选C。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
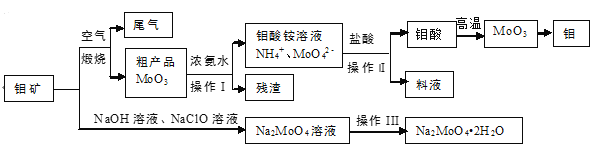
初中学业考试导与练系列答案【题目】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程图如下:

资料:碳酸锂在水中溶解度:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程i研磨粉碎的目的是_______。
(2)过程ii加入足量NaOH溶液的作用是______。
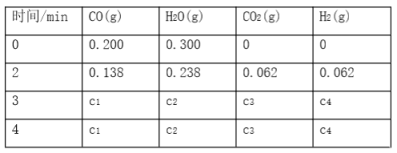
(3)过程iii采用不同氧化剂分别进行实验,均采用Li含量为3.7%的原料,控制pH为3.5,浸取1.5h后,实验结果如下表所示:
序号 | 酸 | 氧化剂 | 浸出液Li+浓度(g/L) | 滤渣中Li含量/% |
实验1 | HCl | H2O2 | 9.02 | 0.10 |
实验2 | HCl | NaClO3 | 9.05 | 0.08 |
实验3 | HCl | O2 | 7.05 | 0.93 |
①实验2中,NaClO3与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为______。
②结合实验结果和①中的现象,最终选择H2O2作为氧化剂,原因是______。
③过程iii得到的浸出液循环两次的目的是_____。
(4)浸出液中存在大量H2PO4和HPO42,已知:H2PO4 HPO42 +H+,HPO42 PO43+H+,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因_____。
(5)对比过程iv和v,说明过程iv不用饱和Na2CO3溶液的原因______。
(6)简述过程vi的操作_______。