题目内容
【题目】下列离子方程式书写正确的是![]()
A.将![]() 加入
加入![]() 中:
中:![]()
B.向![]() 溶液中加入过量的氨水:
溶液中加入过量的氨水:![]()
C.向![]() 溶液中滴加
溶液中滴加![]() 溶液至中性:
溶液至中性:![]()
D.向海带灰浸出液中加入硫酸、双氧水:![]()
【答案】D
【解析】
A.方程式左边3个氧原子,右边4个氧原子,左右氧原子不守恒,正确的为:2Na2O2 +2H2O=4Na + +4OH—+O2 ↑,故A错误;
B.氢氧化铝只能溶解于强碱,不能溶解在氨水弱碱中,向Al2(SO4)3溶液中加入过量的氨水,只能生成氢氧化铝沉淀,正确的为:Al3++3NH3H2O=Al(OH)3↓+3NH4+,故B错误;
C.向Ba(OH)2溶液中滴加NaHSO4溶液,当氢离子和氢氧根离子恰好完全反应时溶液为中性,Ba2+已耗完,Ba(OH)2溶液中钡离子和氢氧根离子比应为1:2,离子方程式为:2H++SO42—+Ba2++2OH—=BaSO4↓+2H2O,故C错误;
D.向海带灰浸出液中加入硫酸、双氧水,双氧水具有氧化性,碘离子具有还原性,发生氧化还原反应,2I—+2H++H2O2=I2+2H2O,两边的各种原子的个数及电荷数相等,故D正确;
答案选D。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】A、B、C、D、E、F、G是前四周期元素,原子序数依次增大,根据表中提供的有关信息,回答问题:
元素 | 相关信息 |
A | 所有单质中密度最小 |
B | 形成化合物种类最多的元素 |
D | 基态原子中只有3个能级,有2个未成对电子 |
E | 短周期中原子半径最大 |
F | 第三周期中电负性最大的元素 |
G | 最外层只有一个电子,内层填满电子 |
(1)E元素在周期表中的位置是______,F元素原子最外层电子排布式为______,BD2的立体构型为______。
(2)由D、E、F三种元素形成的一种常见物质的水溶液显碱性,用离子方程式表示其显碱性的原因:______。
(3)氢化物稳定性:B______D;最高价氧化物对应的水化物酸性:C______F。(填“<”或“>”)
(4)每个B2A4分子中含有______个σ键,______个π键。
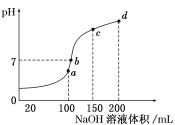
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.61×10-11 |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3-、H3PO4、H2PO4-、HPO42-都看作是酸,则它们酸性最强的是__(填化学式)。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为__。
(3)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是_。
A.c(H+) B.c(H+)c(CH3COO-) C.c(H+)c(OH-) D.![]()
(4)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1__V2(填“>”、“<”或“=”)。
(5)下列四种离子结合H+能力最强的是__。
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(6)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是___
A.Va>10Vb B.Va<10Vb C.Vb<10Va D.Vb>10Va
(7)25℃时,0.1mol/L CH3COOH溶液的pH约为3,向其中加入CH3COONa晶体,待晶体溶解后发现溶液的pH增大。可能的原因有:①__;②__;为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L CH3COOH溶液中加入少量下列物质中的__(选填字母编号),然后测定溶液的pH。
a.CH3COOK固体 b.CH3COONH4固体 c.NH3 d.NaHCO3固体
(8)已知100℃时,水的离子积常数Kw=1.0×10-12,pH=3的CH3COOH和pH=9的NaOH溶液等体积混合,混合溶液呈__性;
(9)等浓度的①(NH4)2SO4、②NH4HSO4、③NH4HCO3、④NH4Cl、⑤NH3H2O溶液中,NH4+浓度由大到小的顺序是:___。