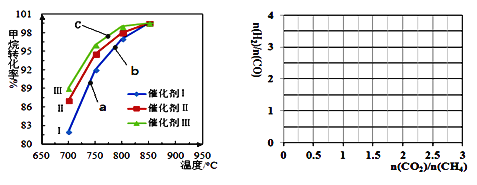
题目内容
【题目】镁一空气电池的工作原理如图所示,电池反应为Mg+O2+2H2O=2Mg(OH)2。下列有关该电池的说法不正确的是(已知阴离子交换膜的作用是只允许阴离子通过)( )
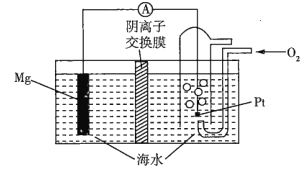
A.通入氧气的电极为正极
B.放电时,溶液中的OH-移向负极
C.负极的电极反应式为Mg-2e-+2OH-=Mg(OH)2
D.当电路中转移0.04mol电子时,参加反应的O2为0.02mol
【答案】D
【解析】
A.从反应可看出,O2为助燃剂,得电子发生还原反应,通入氧气的电极为正极,A正确;
B.原电池工作时,阳离子向正极移动,则阴离子(OH-)向负极移动,B正确;
C.负极上Mg失电子,生成的Mg2+与OH-反应,生成Mg(OH)2,C正确;
D.当电路中转移0.04mol电子时,参加反应的O2为0.01mol,D不正确;
故选D。

练习册系列答案
相关题目
【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和② B. ②和④ C. ③和④ D. ①和③