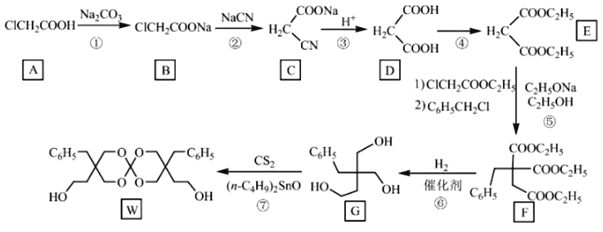
题目内容
【题目】A、B两元素可形成AB型离子化合物,且阴、阳离子具有相同的电子数.A、B的单质均能与水发生剧烈反应,反应中A单质做还原剂,B单质做氧化剂,则下列表述正确的是![]()
A.B元素原子的电子排布式为1s22s22p63s23p5
B.化合物AB的电子式为![]()
C.化合物AB的电子式为![]()
D.A与水反应的离子方程式为![]()
【答案】C
【解析】
A、B两元素可形成AB型离子化合物,则A为+1价,B为-1价,B是卤族元素,A、B的单质均能与水发生剧烈反应,则B为F,AB的阴、阳离子具有相同的电子数,则A为Na。
A.B为F元素,核外有9个电子,其电子排布式为1s22s22p5,故A项错误;
B.化合物AB为NaF,则其电子式为:![]() ,故B项错误;
,故B项错误;
C.化合物AB为NaF,则其电子式为:![]() ,故C项正确;
,故C项正确;
D.Na与水反应生成氢氧化钠和氢气,其离子方程式为2Na+2H2O=2OH—+2Na++H2↑,故D项错误;
答案选C。

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目